一种磁珠蛋白偶联效率的检测方法与流程 |
您所在的位置:网站首页 › mbs偶联 › 一种磁珠蛋白偶联效率的检测方法与流程 |
一种磁珠蛋白偶联效率的检测方法与流程
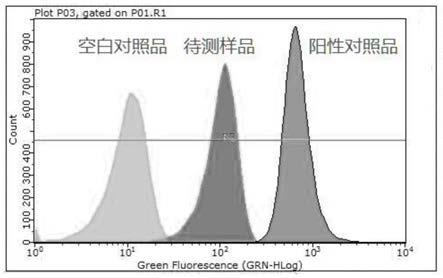 1.本发明涉及生物技术领域,尤其涉及一种磁珠蛋白偶联效率的检测方法。 背景技术: 2.磁珠是是医学、分子生物学、免疫学等研究中的重要载体工具。例如,羧基磁珠具有超顺磁性、快速磁响应性、高羧基含量、单分散性和亚微米尺度粒径等特点,羧基磁珠表面生物分子的修饰是利用碳二亚胺类中的1‑乙基‑(3-二甲基氨基丙基)(edc)缩合的方法,生物活性分子(多肽、蛋白、寡聚核苷酸等生物配体)可通过磁珠表面的官能基团结合,广泛应用于分离、检测和临床诊断等领域中,因为其简便的操作和稳定的结果,得到越来越广泛的应用。3.当磁珠用于蛋白载体时,蛋白偶联效率是一个重要的评价指标,若磁珠的蛋白偶联效率过低,则需要对偶联反应的条件等因素作出进一步的优化。但是,目前并没有可以简单地定量测定磁珠表面蛋白偶联效率和偶联量的方法,研究人员很难得知磁珠的蛋白偶联效果,加大了磁珠作为蛋白载体的应用难度。因此,如何简单、快速地对磁珠表面蛋白偶联效率和偶联量进行相对准确的定量测定,具有十分重要的研究意义。 技术实现要素: 4.基于背景技术存在的技术问题,本发明提出了一种磁珠蛋白偶联效率的检测方法。5.本发明提出的一种磁珠蛋白偶联效率的检测方法,包括下述步骤:6.s1、将活化后的磁珠与蛋白进行偶联反应,得到偶联蛋白的磁珠,然后对所述偶联蛋白的磁珠表面未反应的结合位点进行荧光标记,得到待测样品;7.对活化后的磁珠表面的全部结合位点进行荧光标记,得到阳性对照品;8.以磁珠、活化后的磁珠或者偶联蛋白的磁珠作为空白对照品;9.s2、测定待测样品、阳性对照品、空白对照品的荧光值,按下式计算磁珠的蛋白偶联效率:[0010][0011]优选地,所述磁珠的粒径为1‑5μm。特定包被基团的磁珠对特定物质结合,但是也会吸附一些其他杂质,理论上拥有更大粒径的磁珠,能结合更多的特定生物活性物质,但也会吸附更多的杂质,为不影响后续实验鉴定,本发明优选1‑5um粒径的磁珠。[0012]所述磁珠可以为羧基磁珠、氨基磁珠,优选为羧基磁珠。[0013]优选地,步骤s1中,采用羧基活化剂对羧基磁珠进行活化;优选地,所述羧基活化剂为n‑羟基琥珀酰亚胺和1‑(3‑二甲氨基丙基)‑3‑乙基碳二亚胺盐酸盐的混合溶液;优选地,所述羧基活化剂由浓度为0.1‑0.2mol/l的n‑羟基琥珀酰亚胺溶液和浓度为0.4‑0.7mol/l的1‑(3‑二甲氨基丙基)‑3‑乙基碳二亚胺盐酸盐溶液按体积比1:1混合而成;优选地,所述羧基磁珠的质量与羧基活化剂体积之比为5μg:(1‑5)μl;优选地,所述羧基磁珠进行活化的方法为:将羧基磁珠清洗后,磁分离弃上清,加入羧基活化剂,在室温下振荡孵育20‑30min,磁分离弃上清,清洗,磁分离弃上清,即可。[0014]优选地,步骤s1中,偶联蛋白的羧基磁珠的制备方法为:将活化后的羧基磁珠加入蛋白稀释液中,在室温下振荡孵育1‑3h进行偶联反应,然后磁分离弃上清,清洗,再磁分离弃上清,即可;优选地,所述蛋白稀释液的浓度为0.1‑0.5mg/ml。[0015]优选地,步骤s1中,采用含氨基活性基团的荧光染料进行荧光标记;优选地,所述采用含氨基活性基团的荧光染料为nh2‑peg‑fitc。[0016]优选地,步骤s1中,荧光标记的方法为:将活化后的羧基磁珠或者偶联蛋白的羧基磁珠加入含氨基活性基团的荧光染料配制得到的荧光标记液中,在室温下振荡孵育1‑3h进行荧光标记,然后磁分离弃上清,清洗,再磁分离弃上清,即可;优选地,所述荧光标记液中,含氨基活性基团的荧光染料的浓度为1‑10ng/mol。[0017]优选地,所述荧光标记液是将含氨基活性基团的荧光染料用偶联液稀释得到;优选地,所述偶联液的ph为8.0‑9.8;优选地,所述偶联液的组分如下:3.78g/l nahco3、0.53g/l na2co3、3.68g/l nacl,溶剂为水。[0018]优选地,步骤s2中,采用流式细胞仪测定荧光值。[0019]本发明的有益效果如下:[0020]本发明通过对磁珠偶联蛋白后的剩余活性位点进行荧光标记,与磁珠活性位点全荧光标记以及未经荧光标记作为对比,通过测定荧光值并进行计算,得到磁珠的偶联效率。本发明的方法是一种间接直观鉴定磁珠偶联蛋白效率的方法,利用磁珠结合的稳定性,容易固定以及荧光标记处理较为直观等优点,可以定量确定磁珠偶联蛋白的偶联效率和偶联量,且本发明的方法重复性好,检测结果准确,简单快捷,磁珠用量少。附图说明[0021]图1为本发明实施例1的流式细胞仪检测分析结果。具体实施方式[0022]下面,通过具体实施例对本发明的技术方案进行详细说明。[0023]下述实施例中,nh2‑peg‑fitc购自melopeg,型号111603;il‑5蛋白购自义翘神州,型号15673‑h08h;羧基磁珠购自thermo invitrogen,型号65012。[0024]实施例1[0025]一种磁珠蛋白偶联效率的检测方法,包括下述步骤:[0026]s1、取15μl羧基磁珠悬液(含150μg粒径为1μm的羧基磁珠),用200μl超纯水清洗4次,然后磁分离弃上清,加入30μl羧基活化剂,在室温下振荡孵育20min,磁分离弃上清,用超纯水清洗1次,得到15μl活化后的羧基磁珠悬液备用,羧基活化剂由浓度为0.1mol/l的n‑羟基琥珀酰亚胺水溶液和浓度为0.4mol/l的1‑(3‑二甲氨基丙基)‑3‑乙基碳二亚胺盐酸盐水溶液按体积比1:1混合而成;[0027]取5μl活化后的羧基磁珠悬液,磁分离弃上清,将得到的活化后的羧基磁珠加入100μl荧光标记液中,在室温下振荡孵育1h,然后用100μl dpbs缓冲液清洗4次,磁分离弃上清,得到阳性对照品,其中荧光标记液是将荧光染料nh2‑peg‑fitc用偶联液稀释得到,偶联液的组分如下:3.78g/l nahco3、0.53g/lna2co3、3.68g/l nacl,溶剂为水,ph为9.8,荧光标记液中nh2‑peg‑fitc的浓度为1ng/mol;[0028]取剩余的10μl活化后的羧基磁珠悬液,磁分离弃上清,将得到的活化后的羧基磁珠加入蛋白稀释液中,在室温下振荡孵育1h,磁分离弃上清,用dpbs缓冲液清洗1次,得到10μl偶联蛋白的羧基磁珠悬液备用,其中蛋白稀释液是由10μl浓度为1mg/ml的il‑5蛋白和90μl ph为4.5、浓度为50mmol/l的naac缓冲液混合而成;[0029]取5μl偶联蛋白的羧基磁珠悬液,磁分离弃上清,得到空白对照品;[0030]取剩余的5μl偶联蛋白的羧基磁珠悬液,磁分离弃上清,将得到的偶联蛋白的羧基磁珠加入100μl荧光标记液中,在室温下振荡孵育1h,然后用200μl dpbs缓冲液清洗4次,磁分离弃上清,得到待测样品,其中荧光标记液是将荧光染料nh2‑peg‑fitc用偶联液稀释得到,偶联液的组分如下:3.78g/l nahco3、0.53g/l na2co3、3.68g/l nacl,溶剂为水,ph为9.8,荧光标记液中nh2‑peg‑fitc的浓度为1ng/mol;[0031]s2、分别将待测样品、阳性对照品、空白对照品用dpbs缓冲液定容至400μl,然后用流式细胞仪进行上机检测,测定荧光值,按下式计算羧基磁珠的蛋白偶联效率:[0032][0033]s1、s2中,dpbs缓冲液的浓度为0.1mol/l,ph为7.4。[0034]重复上述实验3次,测试结果以及计算得到的偶联效率如表1所示:[0035]表1羧基磁珠蛋白偶联效率的测试结果[0036][0037]实验结果显示,采用本发明的方法检测羧基磁珠偶联il‑5蛋白的偶联效率为83.55%,重复结果误差不大,稳定性好。[0038]以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。 |
【本文地址】