巨噬细胞全景:分类、极化、功能、疾病诊断与治疗 |
您所在的位置:网站首页 › m1和m2型巨噬细胞区别 › 巨噬细胞全景:分类、极化、功能、疾病诊断与治疗 |
巨噬细胞全景:分类、极化、功能、疾病诊断与治疗
|
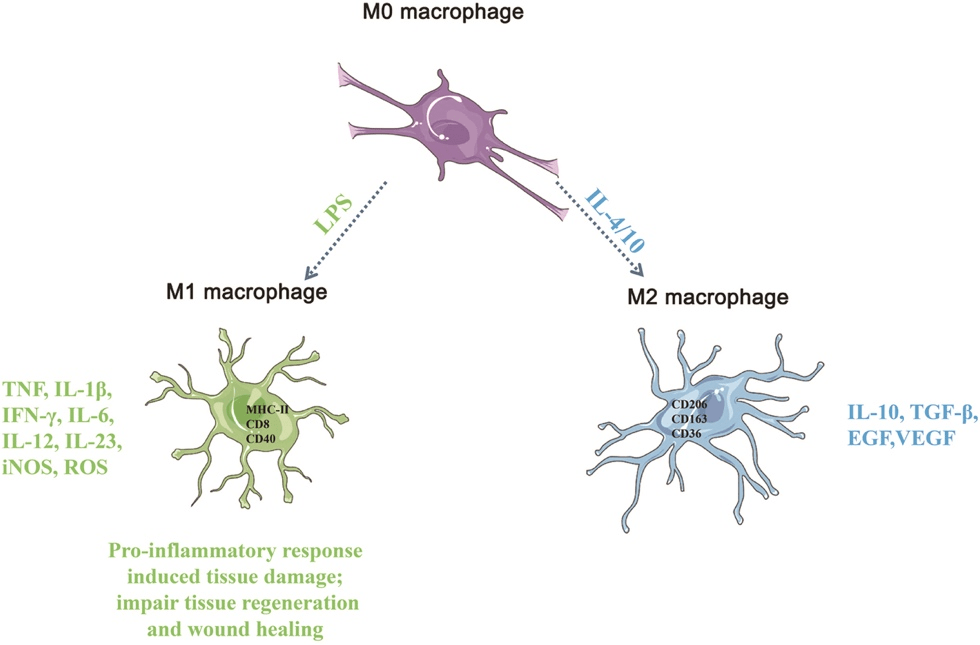
巨噬细胞就像人体免疫系统的巡警,随时盯防,迅速出警。当巨噬细胞出现在血液里,被称为单核细胞,是血液里最大的白细胞,负责先天免疫应答并且调节适应性免疫进程;在肺部时,巨噬细胞是肺部的“吸尘器”,肺泡巨噬细胞负责肺部的清洁,吞噬进入肺泡的尘埃颗粒,通过粘液一起排出体外;当它出现在肝脏里,被称为库普弗细胞(Kupffer cell ),除了吞噬作用,还负责分解衰老的红细胞。此外,脑组织中的小胶质细胞、骨组织中的破骨细胞、鼻窦组织细胞、肾小球内系膜细胞等都属于巨噬细胞。由于它们分布和作用于多种不同组织和器官中,因此巨噬细胞具有多种形态和表型[3] 。 02 巨噬细胞的极化 巨噬细胞具有很高的可塑性,面对不同的病原体或刺激因素时可以向不同方向分化。根据极化后巨噬细胞的表面标志物及其功能,将其分为M1 型(经典活化)巨噬细胞和M2 型(替代激活)巨噬细胞两种主要表型。
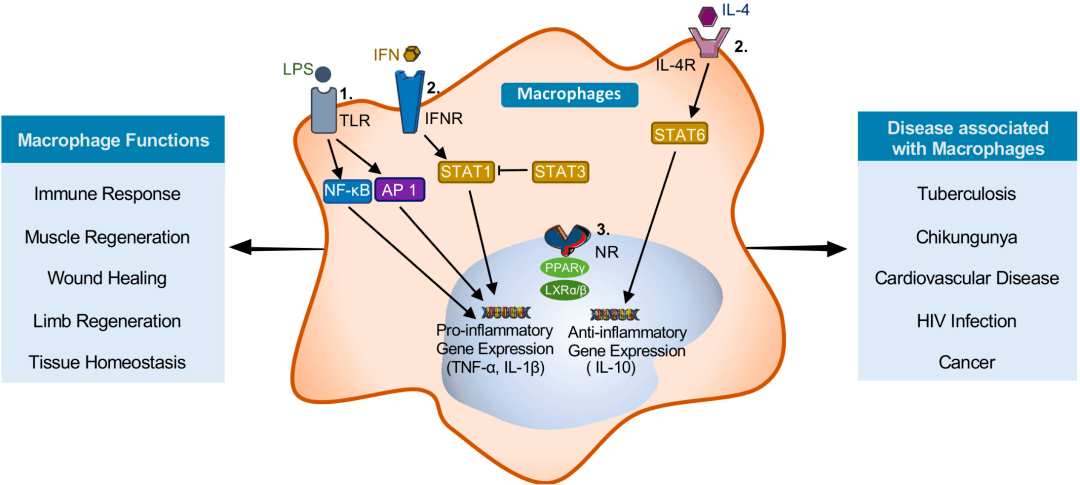
M1 型巨噬细胞:通过给予Toll 样受体(TLR)配体如细菌脂多糖(LPS)来诱发,能吞噬并清除外来病原体,分泌促炎因子,激活T细胞的免疫反应,调节并促进Th1型免疫应答,促进初期炎症反应。 M2 型巨噬细胞:主要通过白细胞介素IL-4 或IL-10诱导其参与抗炎反应,能促进组织修复和伤口愈合,调节Th2型免疫应答,在炎症后期有利于疾病的恢复。 这两种表型在功能、受体表达、细胞因子产生和代谢方面具有不同的特征。此外,在炎症反应过程中两种巨噬细胞的极化能够相互转换,发挥不同功能。因此,巨噬细胞的极化在组织稳态以及炎症和疾病进展中起着至关重要的作用。 03 巨噬细胞的功能 组织损伤后,巨噬细胞会经历明显的表型和功能变化,在组织修复的启动、维持和消退阶段发挥关键作用。巨噬细胞存在于大部分组织中,因此具有不同的功能。
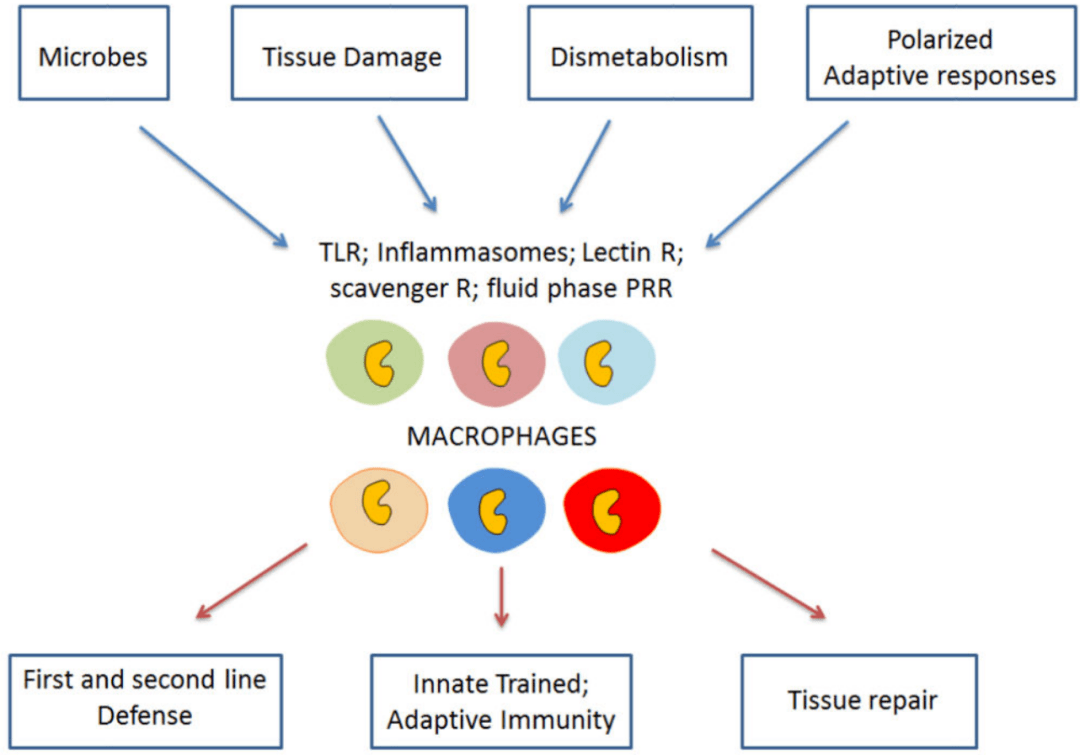
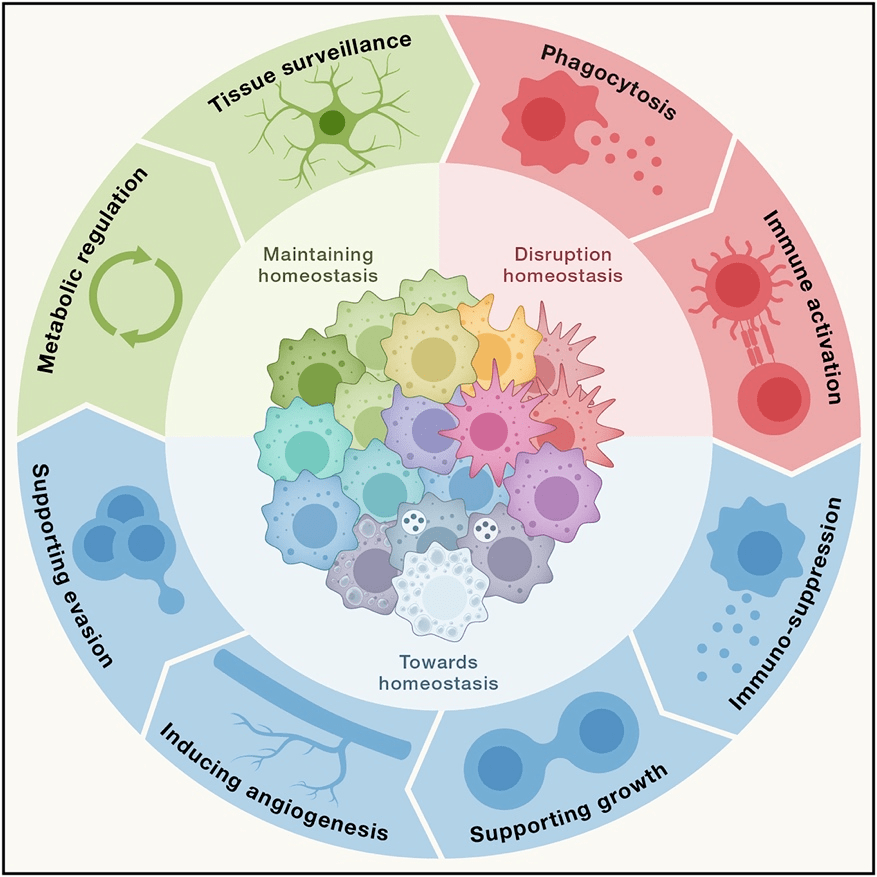
3.1 吞噬作用 3.2 分泌作用 在炎症初期,巨噬细胞通过释放细胞因子等“信号弹”,这些细胞因子和趋化因子反过来将其他免疫细胞募集到炎症部位[4] ,同时执行重要的稳态任务,以确保组织的完整性和功能。 3.3 参与和调节免疫应答 巨噬细胞也可以作为“哨兵”,向T细胞提呈抗原以及诱导其他抗原呈递细胞表达共刺激分子等方面发挥作用,提醒其他免疫细胞“敌军入侵,准备战斗”,从而启动适应性免疫反应。 3.4 趋化性定向运动 巨噬细胞可沿某些化学物质的浓度梯度进行定向移动,聚集到产生和释放这些化学物质的病变部位。 04 疾病中的巨噬细胞 巨噬细胞是多功能和异质的先天免疫细胞,在平衡免疫反应和组织修复以维持体内平衡方面具有中枢功能[5] 。然而,这种功能也与许多疾病的发生有关,包括多种慢性炎症和自身免疫性疾病、癌症、多发性硬化症、类风湿性关节炎、肥胖和纤维化[6] 。许多炎性细胞因子如TNF-α 、IL-1、IL-12、IL-18和IL-23等均可由巨噬细胞分泌,它们是慢性炎症和自身免疫性疾病的重要介质和驱动因素。
由于M1 和M2两种巨噬细胞功能的不同,在炎症发生发展时期,M1与M2细胞比例会不断变化,直至炎症完全消除。而在某些特定的炎症进程中,M1与M2细胞的比例失调,会导致严重的炎症因子风暴等不良症状。因此,可以通过调节M1细胞和M2细胞比例,对炎性疾病开展针对性治疗。 05 肿瘤相关巨噬细胞(TAMs) 肿瘤相关巨噬细胞(tumor associate macrophage ,TAM)指被募集到肿瘤微环境(TME)中的巨噬细胞,对肿瘤的发生和发展具有根本性的影响。巨噬细胞具有可塑性,一旦被恶性生长所吸收,就会在肿瘤微环境中协调多种相互作用,特别是在基质重塑、血管生成、转移和肿瘤进展以及对化疗药物和检查点阻断免疫疗法的抵抗[7] ,从而推动癌症生态系统的进化。而当巨噬细胞适当激活时,可以介导癌细胞的吞噬作用和细胞毒性的肿瘤杀伤作用,并且协调先天和适应性免疫系统的组成部分相互作用。
早期研究认为巨噬细胞具有抑制肿瘤的作用,但是后续研究发现TAM 能够通过抑制免疫反应,促进血管生成,刺激肿瘤细胞浸润及转移等机制促进肿瘤恶化。并且在此过程中巨噬细胞能够维持慢性炎症,有助于肿瘤的发生和发展。当组织发生长期的损伤时,异常的巨噬细胞会持续分泌炎性细胞因子并且募集其他免疫细胞。一旦肿瘤形成,就会使巨噬细胞从免疫活性状态分化为免疫抑制状态。 TAM 可以呈现经典的M1样或替代的M2样激活状态。在经典观点中,M1样的TAM具有促炎性,对消除肿瘤细胞有好处,而M2样TAMs的丰度与免疫抑制性TME和各种人类癌症(包括胶质母细胞瘤、乳腺癌、胰腺癌、头颈癌、肾癌和淋巴瘤)的预后不良密切相关。具体而言,TME中M2样TAM的比例较高,已被证实与更具侵袭性的癌症相关,因为它们在多个维度上有助于肿瘤恶性肿瘤,包括免疫抑制性TME、血管生成、内渗、侵袭和转移[8] 。由于巨噬细胞对肿瘤的发生和发展具有重要的促进/ 抑制作用,因此已被用作癌症治疗与诊断的靶标。 06 利用巨噬细胞进行癌症诊断 巨噬细胞作为TME 的协调者起着至关重要的作用,并表现出与癌细胞和其他免疫细胞的协调整合。因此,TME中的巨噬细胞正在成为具有前景的治疗诊断靶标。目前正在开发的巨噬细胞靶向治疗诊断学旨在通过检测TAM 的景观来精确诊断癌症,并通过抑制TAM的募集和存活,调节TAM的极化以及增强TAM的吞噬作用来寻求有效的癌症治疗。
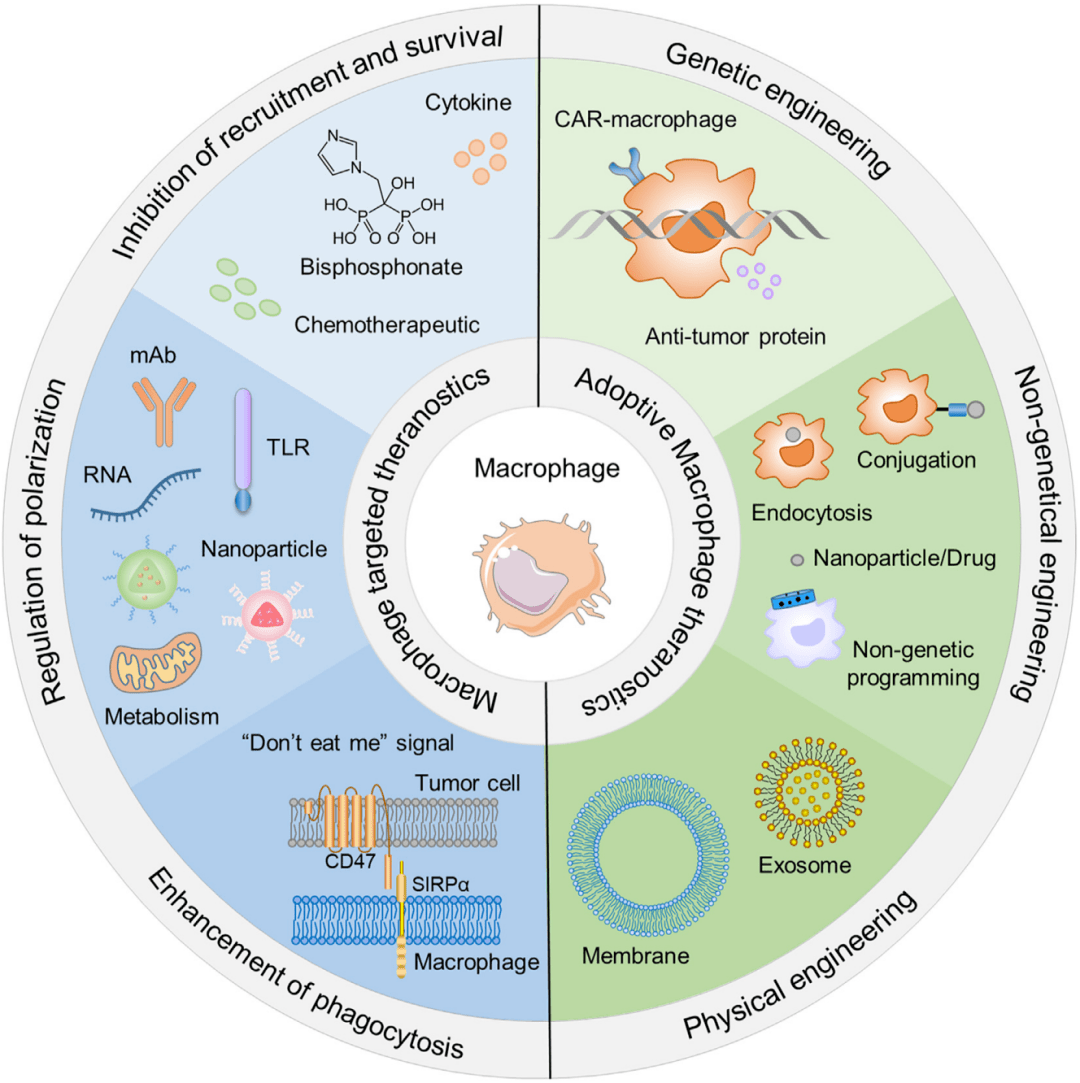
6.1 通过检测TAMs的景观实现精确的癌症诊断 随着医学成像技术的快速发展,TAMs 群体的无创可见跟踪在癌症精准诊断和临床治疗中越来越受到重视。例如通过使用S100A9特异性探针的体内光学成像可以估计TAM的活性和募集,对肿瘤进展的预测具有重要价值,此外还可以通过使用TAMs靶向的正电子发射断层扫描(PET)成像以非侵入性和平移方式定量鉴定TAM的内容和动态时空分布。通过与高分辨率体内共聚焦显微镜集成,结合PET成像结果表明,较高的TAMs丰度与肿瘤中纳米治疗药物的通透性和保留性增强密切相关,这意味着TAM的成像可以指导患者选择纳米医学试验。原则上,当将成像标签与治疗剂相结合时,TAMs靶向治疗诊断学有可能通过可视化TME的时空演变来提供促进信息,以实现临床上增强的精确治疗决策。 6.2 抑制TME中巨噬细胞的募集和存活
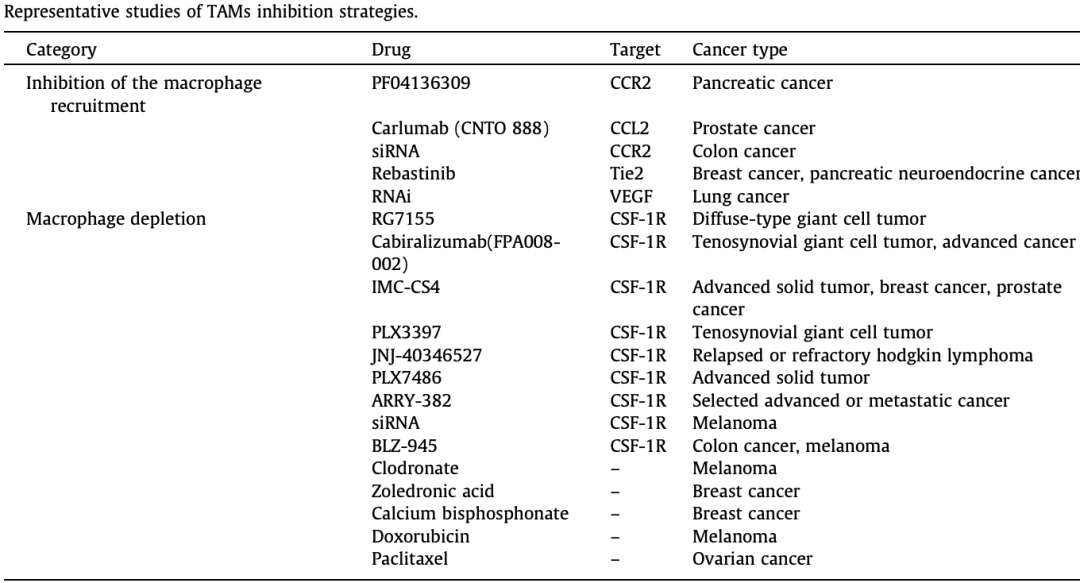
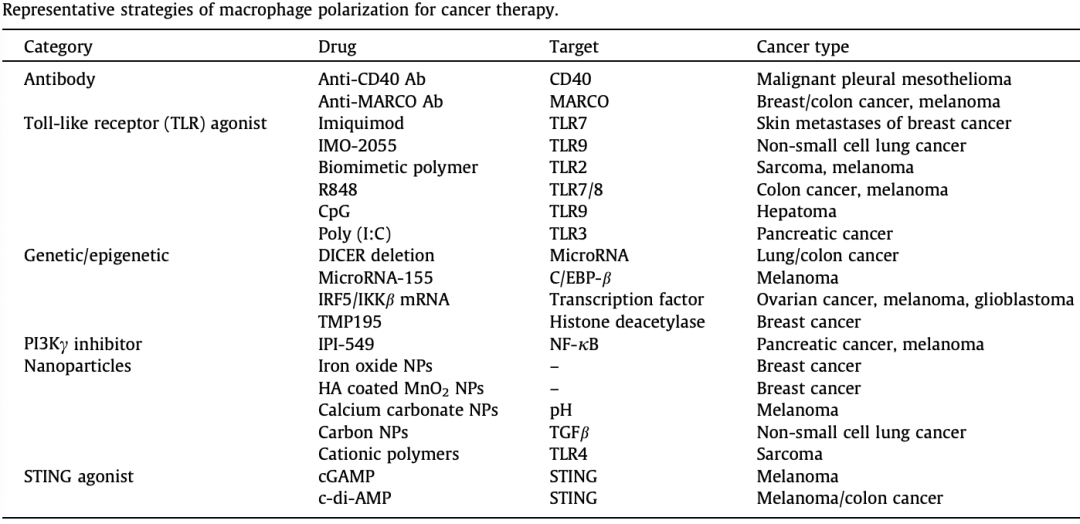
尽管关于TME 中巨噬细胞的起源存在一些争议,但目前的证据表明,外周单核细胞通过肿瘤衍生的多种趋化因子(CCL2、CCL3、CCL4、CCL5和CXCL12)和细胞因子(CSF-1和VEGF)招募来补充TME中的巨噬细胞。TME中巨噬细胞的丰度与肿瘤进展和预后不良密切相关。因此,这些信号分子是有希望的治疗靶点,可以有效抑制巨噬细胞在TME中的积累。 尽管TAMs 耗竭在抑制肿瘤进展方面具有相当大的效率,但对TAM的耗竭水平和持续时间的精确操作非常重要,巨噬细胞的过度消耗可能会破坏免疫稳态,同时增加感染和自身免疫性疾病的风险。同时,需要增加药物剂量以实现持久的TAM耗竭,这不可避免地会引起不良反应,这仍然是临床转化的主要缺点。因此,需要更多的临床尝试和经验来促进这种治疗策略的成熟。 6.3 巨噬细胞极化的调节 TME 中巨噬细胞的可塑性已经得到充分确立,调节巨噬细胞向杀肿瘤表型的极化是根除肿瘤的替代策略。目前正在研究的巨噬细胞极化调节策略主要集中在巨噬细胞靶向抗体、Toll 样受体(TLR)激动剂、遗传/表观遗传调控、磷酸肌醇3-激酶-γ(PI3Kγ)抑制剂、特异性纳米颗粒和干扰素基因刺激剂(STING)激动剂。在纳米材料的帮助下,TAM偏振和成像模式的集成能够实现“一体化”高效的癌症治疗诊断学。
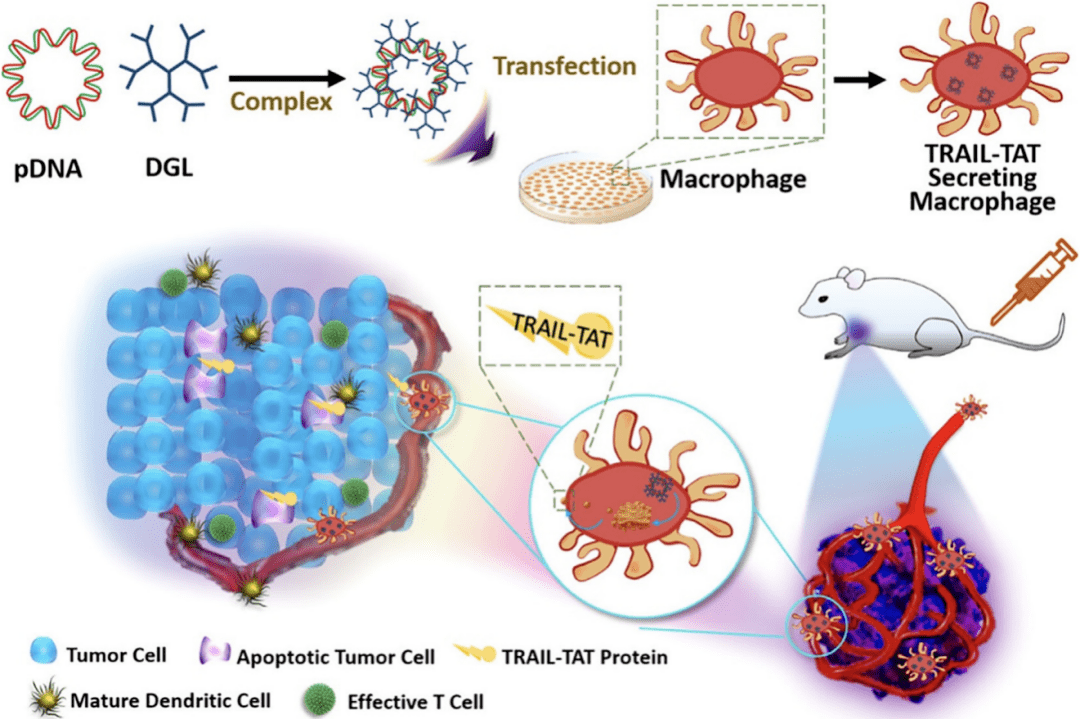
6.4 利用工程过继巨噬细胞进行癌症治疗诊断学 巨噬细胞也被用作癌症治疗诊断的治疗剂和药物递送载体,因为它们具有固有的肿瘤归巢能力、血液循环隐身性和异物的强效吞噬作用。由于与肿瘤转移和侵袭的强烈关联,巨噬细胞具有在早期阶段靶向潜在转移区域的天然能力。这使得巨噬细胞成为将治疗剂或诊断剂输送到肿瘤部位的合适载体。因此,作为转运体的巨噬细胞提供了多方面的好处,包括高度特异性的肿瘤部位积累,有效逃避免疫监视以及跨越生物屏障。目前基于巨噬细胞的工程疗法已发展到三个方面:①具有增强治疗诊断作用的基因工程巨噬细胞;②巨噬细胞作为输送载体;③巨噬细胞作为输送载体。 6.4.1基因工程巨噬细胞 随着基因编辑和合成生物学的快速发展,通过基因工程手段,许多细胞都可以被赋予治疗行为。在经典的嵌合抗原受体(CAR)T细胞治疗成功范例中,患者从身体中分离出T细胞,重编程其基因,使其展现出有效的癌细胞杀伤能力,因此FDA在2017年批准其用于治疗B细胞急性淋巴细胞白血病。同样的,基因工程巨噬细胞具有强力的抗肿瘤效应,在癌症治疗中具备极大的潜力。目前已详细设计出带有CAR的巨噬细胞(CAR-Ms),通过重组人类巨噬细胞的CARs,以刺激肿瘤吞噬功能[9] 。通过转导并诱导CAR-Ms呈现M1型表型,分泌促炎细胞因子以重极化TME中的M2巨噬细胞,促进T细胞的免疫应答。
巨噬细胞能作为生物反应器,可以在肿瘤部位特异性定植并原位表达抗肿瘤大分子蛋白药物。工程化巨噬细胞生物反应器的注射实现了有效的肿瘤抑制,为提高蛋白药物递送效率提供了新的途径。此外,还能利用巨噬细胞的内在肿瘤敏感性,采用荧光素酶表达模块进行改造,利用细胞传感器进行微小肿瘤检测。随着 TME中巨噬细胞的代谢改变,利用生物发光成像,通过工程过继巨噬细胞成功检测到大小为 25-50 mm的肿瘤,可用作早期癌症的诊断。 6.4.2非基因工程巨噬细胞 巨噬细胞在循环中具有逃避单核吞噬系统( MPS)的能力,因此也被用作药物和纳米颗粒库。基于巨噬细胞的药物输送载体可以延长血液循环时间并降低有效载荷的毒性和免疫原性。巨噬细胞被募集到肿瘤部位后,能够渗透到传统的药物递送系统难以达到的肿瘤组织的深部缺氧区域。随着基于巨噬细胞的细胞载体的爆炸性发展,一些类似的策略,例如通过利用金纳米棒( AuNRs)的光热效应从而降低肿瘤的负担。使用巨噬细胞作为运输载体,将牛血清白蛋白包被的 AuNRs输送到肿瘤组织,对整个肿瘤组织的有效光热消融,从而增加肿瘤抑制并减少肿瘤复发。 由于纳米颗粒的生物调控,极化巨噬细胞的先天能力得到了实质性的提高,例如更有效的肿瘤靶向,更有效的生物活性成分生成,对免疫抑制TME 的抵抗力以及原位将促肿瘤的M2 巨噬细胞转化为抗肿瘤的M1 表型的强大能力。因此,人工巨噬细胞显示出作为协同癌症治疗的治疗生物制剂的有希望的潜力。 结 语 在过去的几十年里,巨噬细胞相关治疗诊断学在各种疾病模型上进行了多种探索,这些模型具有广泛的炎症成分,包括癌症、关节硬化、肾病和自身免疫性等疾病。未来利用巨噬细胞来治疗疾病已经成为趋势,因此我们需要对巨噬细胞的发育、表型和功能的差异有更深入的了解。研究不同亚型的巨噬细胞在多种疾病以及肿瘤中的功能可以帮助人们更好的了解和调控疾病的发生发展,起到事半功倍的作用。 巨噬细胞已被专门用于癌症治疗诊断学,遵循两种主要的治疗策略,包括调节 TAM作为感兴趣的治疗靶点,以及利用过继工程巨噬细胞作为治疗生物制剂和药物转运蛋白。尽管使用工程巨噬细胞的过继细胞疗法在临床应用中显示出广阔的潜力,但具有严格质量控制的大规模生产和潜在的生物安全问题仍然是未来必须克服的两大挑战,以便转化为临床应用。综上所述,深入研究药代动力学、药效学以及与巨噬细胞介导的递送相关的表型转化,对于增强治疗效果和减少副作用很有价值。精准确定输注巨噬细胞或巨噬细胞定向药物递送的运输和位置至关重要。 主要参考文献 1. Hirayama, D., T. Iida, and H. Nakase, The Phagocytic Function of Macrophage-Enforcing Innate Immunity and Tissue Homeostasis. Int J Mol Sci, 2017. 19(1). 2. Yang, D., et al., A sweet spot for macrophages: Focusing on polarization. Pharmacological Research, 2021. 167: p. 105576. 3. Chen, Y. and X. Zhang, Pivotal regulators of tissue homeostasis and cancer: macrophages. Exp Hematol Oncol, 2017. 6: p. 23. 4. Pollard, J.W., Trophic macrophages in development and disease. Nature Reviews. Immunology, 2009. 9(4): p. 259-270. 5. Laskin, D.L., et al., Macrophages and tissue injury: agents of defense or destruction? Annu Rev Pharmacol Toxicol, 2011. 51: p. 267-88. 6. Wynn, T.A., A. Chawla, and J.W. Pollard, Macrophage biology in development, homeostasis and disease. Nature, 2013. 496(7446): p. 445-55. 7. Mantovani, A., et al., Macrophages as tools and targets in cancer therapy. Nat Rev Drug Discov, 2022. 21(11): p. 799-820. 8. Liu, L., et al., Leveraging macrophages for cancer theranostics. Advanced Drug Delivery Reviews, 2022. 183: p. 114136. 9. Klichinsky, M., et al., Human chimeric antigen receptor macrophages for cancer immunotherapy. Nature Biotechnology, 2020. 38(8): p. 947-953.返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |