基于LEPR单克隆抗体特异性识别细胞分选系统的应用 |
您所在的位置:网站首页 › lef1抗体 › 基于LEPR单克隆抗体特异性识别细胞分选系统的应用 |
基于LEPR单克隆抗体特异性识别细胞分选系统的应用
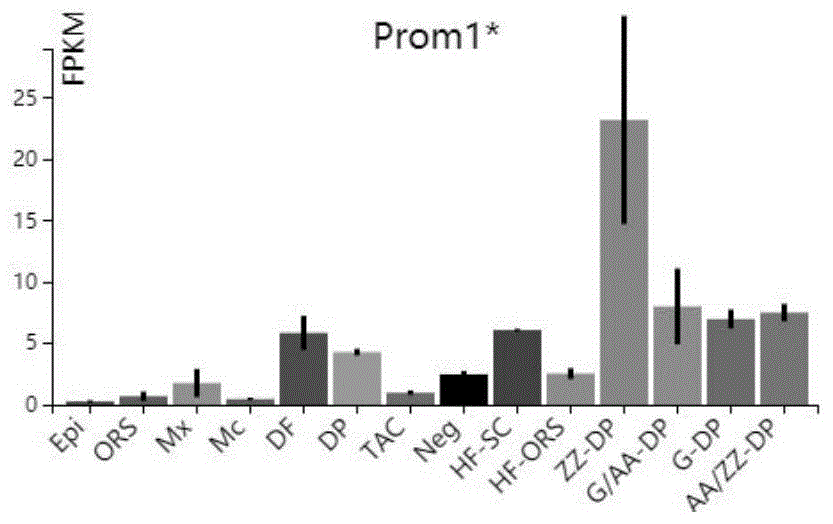 本发明涉及生物医药技术领域,尤其涉及一种基于lepr单克隆抗体特异性识别的哺乳动物真皮毛乳头细胞分选系统的应用。 背景技术: 真皮乳头细胞(dp细胞)由中胚层发育而来,是一种特殊的间充质干细胞,在毛囊的形成和毛发生长中发挥着至关重要的作用,它所释放的信号直接调控了毛囊干细胞和毛囊中黑色素干细胞的维持、激活、生长与分化;在体外,dp细胞和毛囊干细胞混合可以重建毛囊组织再生毛发,小鼠实验证实将它注射到皮下可诱导毛发进入生长期,dp细胞由于可以分泌各种生长因子,因而也能支持皮肤干细胞、毛囊干细胞以及黑色素干细胞的体外增殖以及干性的保持,对于利用这些干细胞治疗相关疾病,比如脱发、白发、白癜风、烧伤、创伤、皮肤遗传病等有非常重要的意义。现有分离dp细胞的方法有以下3种: 1、采用微手术解剖的方式:使用解剖针、镊子和剪刀等工具用物理分离的方式将dp细胞分离出来。 2、采用转基因鼠的方法:利用转基因技术使dp细胞表达某种特异性的荧光蛋白,再利用流式细胞仪分选和收集dp细胞。如有人已采用lef1作为启动子,表达荧光蛋白,而lef1只在dp细胞中表达,从而可以达到通过分选荧光蛋白来分选dp细胞的目的。 3、利用耦联有生物素的cd133抗体特异性标记dp细胞,再利用流式细胞仪筛选识别生物素的荧光二抗,从而分选dp细胞。 然而,微型解剖分离dp细胞的方法耗时耗力、效率低下,而且只适用于解剖比较大的毛囊,例如小鼠胡须毛囊、人的头皮毛囊。对于小毛囊如小鼠背部皮肤毛囊则无法操作。利用转基因鼠的方法分离dp细胞,构建转基因小鼠成本比较高,而且操作复杂,繁育小鼠的过程比较漫长。利用cd133抗体标记小鼠背部皮肤毛囊dp细胞,再通过流式细胞仪分选结合有荧光二抗的dp细胞,目前只发现一种细胞膜蛋白cd133可以用来分选dp细胞,但是cd133不能特异性识别dp细胞,如图1所示,因而无法实现有效分选dp细胞。 因此,本领域的技术人员致力于开发一种能够在体外特异性识别且大量分离dp细胞的方法。 技术实现要素: 有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是针对微型解剖分离dp细胞的方法耗时耗力、效率低下,而且只适用于解剖比较大的毛囊的问题,提供一种分离哺乳动物真皮毛乳头细胞的方法。 为实现上述目的,本发明提供了一种基于lepr单克隆抗体特异性识别的细胞分选系统的应用,细胞分选系统包含以下组分:lepr单克隆抗体、荧光二抗和毛囊真皮乳头细胞,lepr单克隆抗体特异性标记毛囊真皮乳头细胞,荧光二抗特异性标记lepr单克隆抗体。 进一步的,细胞分选系统分选毛囊真皮乳头细胞的方法包括如下步骤: (1)采用酶消化法制备毛囊真皮乳头细胞悬浮液, (2)用lepr单克隆抗体特异性标记细胞悬液中的毛囊真皮乳头细胞, (3)荧光二抗特异性结合lepr单克隆抗体, (4)根据荧光二抗的发射波长划门设置分选条件分选毛囊真皮乳头细胞。 进一步的,步骤(1)具体为以下步骤: (1.1)选取毛发处于生长期的小鼠,断颈法处死小鼠, (1.2)划取皮肤区域,剃掉毛发,洗净皮肤, (1.3)预先准备10cm培养皿,放入预冷的1×pbs缓冲液,置于冰上,剪取皮肤置于培养皿中,1×pbs缓冲液洗干净, (1.4)将真皮面朝上,用镊子撕掉真皮侧的脂肪层,不要破坏毛囊, (1.5)取3ml0.25%的胶原酶置于6cm培养皿中,预热至37℃,将皮肤置于胶原酶中37℃消化,消化时间为0.5h–2h,充分消化的皮肤为透明状, (1.6)准备新的6cm培养皿,预先放入5ml室温1×pbs,将皮肤转移至新的培养皿中,轻轻洗掉胶原酶,重复2次, (1.7)吸掉pbs,加入3ml0.25%的胰酶,放入摇床37℃、25rpm消化20-30min,消化完转移至冰上,后面操作均在冰上或者4℃环境中, (1.8)将皮肤剪成2mm×2mm小块, (1.9)加入3mldmem,终止胰酶消化,用10ml移液管全体积吹打10–12次,形成细胞悬液, (1.10)细胞悬液过40μm细胞滤器,滤液转移至50ml离心管中, (1.11)用dmem清洗培养皿,清洗液过40μm细胞滤器,滤液转移至50ml离心管中, (1.12)1500rpm,4℃,离心5min,吸掉上清, (1.13)用预冷的pbs-f缓冲液重悬细胞并计数,先用2mlpbs-f缓冲液轻轻吹匀,再加3ml重悬毛囊真皮乳头细胞悬浮液。 进一步的,lepr单克隆抗体的制备方法包括如下步骤: (i)用lepr重组蛋白抗原免疫两只新西兰大白兔,elisa方法检测血清滴度, (ii)b细胞体外培养和上清筛选出针对特异性抗原的阳性克隆, (iii)重组lepr单克隆抗体, (iv)将目标克隆进行大提质粒制备后进行转染生产,将转染上清进行proa亲和柱纯化lepr单克隆抗体,并进行缓冲液置换,最终将lepr单克隆抗体保存于pbs缓冲液中。 进一步的,步骤(i)中免疫部位为皮下多点注射,免疫滴度合格标准为od1:64000>0.8。 进一步的,步骤(ii)具体为:取兔子脾脏,分离b细胞,铺板,体外进行培养,加入细胞生长因子,饲养细胞,培养10-15天后进行上清检测;取上清,进行初筛,挑选针对特异性抗原的阳性克隆;将elisa阳性克隆的上清进行wb\fc\icc\ihc验证;将阳性克隆全部挑选出,制备细胞裂解液,保存于-80℃。 进一步的,步骤(iii)具体为取top10克隆进行抗体重组;利用特异性pcr引物,调取重链和轻链的可变区序列;测序验证后,进行质粒构建,并制备小提质粒用于转染测试;经转染,上清elisa检测阳性后,再进行wb\fc\icc\ihc验证;确定阳性克隆抗体重组质粒对。 本发明还提供一种分选毛囊真皮乳头细胞的试剂盒,其特征在于,包含lepr单克隆抗体、荧光二抗和pbs缓冲液,lepr单克隆抗体特异性标记毛囊真皮乳头细胞,荧光二抗特异性标记lepr单克隆抗体。 本发明另一方面提供基于lepr单克隆抗体特异性识别的毛囊真皮乳头细胞在毛发生长中的应用。 技术效果 与现有技术相比,本发明的细胞分选系统可以特异性的,高效的大量分选毛囊dp细胞。 本发明分选的细胞在体外培养扩增后具有功能性:1)能与上皮干细胞混合后重建毛发;2)注射到毛发静止期皮下可以促进毛发的生长。 本发明的细胞分选系统能够较容易的实现商业化,对我国防脱发的产业做出实质性的贡献。 以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。 附图说明 图1是现有技术的prom1/cd133在毛囊中的表达情况; epi,epidermis,表皮;ors,outrootsheath,外根鞘;mx,matrix,毛基质 df,dermalfibroblast,真皮成纤维细胞;dp,totaldermalpapillacells,总的毛乳头细胞;tac,transitamplifyingcells,短暂增殖细胞;neg,mixtureofunlabeledcells,未标记细胞的混合体;hf-sc,hairfolliclebulgestemcell,毛囊干细胞;hf-ors,orsminusstemcell,外根鞘干细胞;zz-dp,zigzagdp,之字形毛囊真皮乳头;g/aa-dp,guard/awlandauchenedp,保护毛囊/锥形毛囊真皮乳头细胞;g-dp,guarddp,保护毛囊真皮乳头细胞;aa/zz-dp,awlandauchene/zigzagdp,锥形毛囊/之字形毛囊真皮乳头细胞; 图2是本发明的实施例1的对照组的流式图; 图3是本发明的实施例1用lepr抗体分选小鼠背部皮肤毛囊dp细胞流式图; 图4是本发明的实施例2的裸鼠背部重建毛发图; 图5是本发明的实施例2中的lepr+dp细胞可以显著诱导毛发图。 图6是本发明的lepr抗体在小鼠和大鼠特异性标记dp的荧光图。 具体实施方式 以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。 本文中述及的“lepr”指瘦素受体编码基因,由该基因编码的蛋白可以识别和转运瘦素。“lepr+dp”指分选下来的fitc阳性细胞群。“lepr-dp”指分选下来的fitc阴性细胞群。 实施例1 本发明提供了一种基于兔单克隆抗体分选真皮乳头细胞的方法,该方法包括以下具体步骤: 步骤1:lepr兔单克隆抗体的制作 1.1免疫及血清检测 免疫:用lepr重组蛋白抗原免疫两只新西兰大白兔;免疫部位:皮下多点注射。 血清检测:elisa方法检测血清滴度。免疫滴度合格标准为od1:64000>0.8。 elisa合格的血清再进行wb\fc\icc\ihc检测。 1.2b细胞体外培养和上清筛选 取兔子脾脏,分离b细胞,铺板,体外进行培养,加入细胞生长因子,饲养细胞,培养10-15天后进行上清检测。 取培养上清,进行初筛,挑选针对特异性抗原的阳性克隆。 将elisa阳性克隆的上清进行wb\fc\icc\ihc验证。 将阳性克隆全部挑选出,制备细胞裂解液,保存于-80℃。 1.3克隆重组 取top10大肠杆菌克隆进行抗体重组。利用特异性pcr引物,调取重链和轻链的可变区序列。 测序验证后,进行质粒构建,并制备小提质粒用于转染测试。 经转染,上清elisa检测阳性后,再进行wb\fc\icc\ihc验证。 确定阳性克隆抗体重组质粒对。 1.4抗体生产 将最优克隆进行大提质粒制备。 进行转染生产。 将转染上清进行proa亲和柱纯化抗体,并进行缓冲液置换,即用pbs置换gly-hcl,tris缓冲液,最终保存缓冲液为pbs。 步骤2:分离出生30天小鼠皮肤毛囊dp细胞 试剂:预冷1×pbs缓冲液,室温1×pbs缓冲液,无钙胰酶原液,collagenase(胶原酶),含4%血清dmem,4%pbs-f(胎牛血清加入1×pbs中,浓度为4%)。pi(碘化丙啶,浓度为1.5mg/ml) 耗材:40μm细胞过滤网,50ml离心管,1.5mlep管,10cm培养皿,6cm培养皿,无菌镊子,无菌剪刀,电动剃毛推。 大规模快速分选哺乳动物毛囊dp细胞采取的技术方案: 采用步骤1中制备得到的lepr兔单克隆抗体特异性标记的毛囊真皮乳头细胞(dp细胞)悬液,再用荧光二抗特异性结合一抗,最后采用流式细胞仪对标记有荧光二抗的dp细胞进行大规模的分选和收集,即可在最短的时间内收集到大量的dp细胞。 包括以下几个步骤: 步骤a制备毛囊dp细胞的悬液,可以采用酶消化的方法制备单细胞悬液,如胰酶和胶原酶,具体为:整个操作环境在无菌环境下操作 断颈法处死小鼠。(选取的小鼠的毛发处于生长期,一般选取出生30天的b6小鼠,即c57bl/6小鼠,够自上海杰思捷实验动物有限公司。) 划取皮肤区域,剃掉毛发。 洗净皮肤。 预先准备10cm培养皿,放入预冷的1×pbs缓冲液,置于冰上。剪取皮肤置于培养皿中,用1×pbs缓冲液将皮肤洗干净。 将真皮面朝上,用镊子撕掉真皮侧的脂肪层。注意不要破坏毛囊。 取3ml0.25%的胶原酶置于6cm培养皿中,预热至37℃。将皮肤置于胶原酶中37℃消化。(置于37℃摇床中,25rpm)消化时间为0.5h–2h。充分消化的皮肤为透明状。 准备新的6cm培养皿,预先放入5ml室温1×pbs缓冲液。将皮肤转移至新的培养皿中,轻轻洗掉胶原酶。重复2次。 吸掉pbs缓冲液,加入3ml0.25%的胰酶,放入摇床37℃、25rpm消化约30min。 消化完转移至冰上。后面操作均在冰上或者4℃环境中。 剪碎皮肤(剪成大概2mm×2mm小块)。 加入3mldmem,终止消化,用10ml移液管全体积吹打10–12次。 细胞悬液过40μm细胞滤器,滤液转移至50ml离心管中。(冰上操作) 用dmem清洗培养皿,清洗液过40μm细胞滤器,滤液转移至50ml离心管中。 1500rpm,4℃,离心5min。吸掉上清。 用预冷的pbs-f缓冲液重悬细胞并计数。先用2mlpbs-f缓冲液轻轻吹匀,再加3mlpbs-f缓冲液重悬。(成年小鼠背部皮肤提取的细胞数大概是2–5×107cells/ml) 步骤bfacs样品制备 将步骤a中的细胞悬液分装成多管(用1.5mlep管分装),实验组的细胞浓度为2×107cells/ml,对照组细胞数量为106个,使其体积为800μl。对照组不加一抗,只加二抗和pi(碘化丙啶,可以对死亡细胞的dna进行染色,故可用pi染料区分死活细胞)。剩下用作细胞分选。(以下步骤中的对照和实验组同步处理。) 步骤clepr单克隆抗体特异性结合dp细胞 所有的细胞样品250g/1500rpm,4℃,离心5min。 吸取500μl细胞悬液至1.5mlep管,加入一抗孵育,4℃,1h,放在旋转仪中旋转。lepr1:100稀释。(稀释比考虑细胞的数量和溶液体积)加入500μlpbs-f缓冲液至1.5mlep管,上下颠倒清洗细胞。 250g/1500rpm,4℃,离心5min,吸掉上清。 加入500μlpbs-f缓冲液重悬。 加入荧光二抗孵育30min,4℃。暗环境,旋转仪中旋转。(二抗的信息为alexa488-conjugatedaffinipuredonkeyanti-rabbit,jacksonimmunoresearch,按说明书配置后,浓度1.5mg/ml,工作浓度:1:200稀释) 加入500μlpbs-f缓冲液至1mlep管,上下颠倒清洗细胞。 250g/1500rpm,4℃,离心5min,吸掉上清。 加入pbs-f缓冲液重悬细胞,置于冰上。 分选前5min左右,加入pi,混合。pi1:1000稀释。 分选前准备无菌ep管,准备pbs-f用作清洗流式通道。 步骤ddp细胞分选 以分选的条件fitc阳性,pi阴性划门,高速分选dp细胞。 图2是本发明的对照组流式图。在不加一抗,加二抗的条件下,几乎无dp细胞被分选。图3是本发明用lepr抗体分选小鼠背部皮肤毛囊dp细胞流式图。分选的效率为1.74%,一只成年鼠的细胞产量大约为2-5×107个,因此一只成年鼠分选获得的dp细胞量约是348000-870000个细胞。 实施例2验证lepr+dp细胞的活性 将分选的lepr+dp细胞培养3代,细胞量1425000个,和新生鼠表皮细胞,细胞量4000000个,混合后移植入裸鼠背部,如图4a所示,长毛,箭头指向再生的毛发。图4b只加新生鼠表皮细胞,细胞量4000000个,未长毛。图4c分选lepr-dp细胞培养3代,细胞量1850000个,和新生鼠表皮细胞,细胞量4000000个,混合后移植入裸鼠背部,未长毛。 如图5所示,将40天年龄(毛发静止期)的c57/b6小鼠剃除背部毛发,lepr+dp细胞培养3代后将1×106细胞注射到小鼠背部右侧,左侧未注射作为对照,另外设置lepr-阴性细胞和pbs注射对照。结果中可以观察到dp细胞可以显著诱导毛发生长。 实施例3基于lepr单克隆抗体特异性识别的细胞分选系统具有广谱性,可以用于其它的哺乳动物本发明的细胞分选系统,不仅可用于分离小鼠真皮乳头细胞,还可以用来分离其它具有科研和经济价值的哺乳动物的真皮乳头细胞,如大鼠,人的真皮乳头细胞。 如图6a,lepr抗体特异性标记小鼠毛囊真皮乳头细胞,再用耦联有荧光素fitc的抗体结合lepr抗体所做出的荧光图。图6b,lepr抗体特异性标记大鼠毛囊真皮乳头细胞,再用耦联有荧光素fitc的抗体结合lepr抗体所做出的荧光图。比例尺为20微米。 以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。 |
【本文地址】