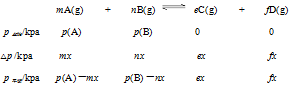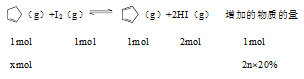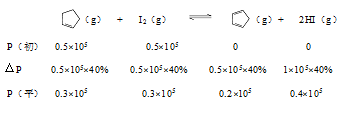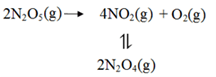高考化学压力平衡常数Kp及其相关计算 |
您所在的位置:网站首页 › kp计算例题答案 › 高考化学压力平衡常数Kp及其相关计算 |
高考化学压力平衡常数Kp及其相关计算
|
根据理想气体状态方程PV=nRT,可推知: 三、计算模式——三段式 一定温度下,向刚性密闭容器中充入A、B两种气体,发生气相反应: m A(g) + n B(g) e C(g) + f D(g) 令A、B起始分压分别为 p (A)、 p (B),达到平衡后A气体分压的减小值为 m x 。
例1. 2019年全国2卷27(节选)某温度下,等物质的量的碘和环戊烯()在刚性容器内发生反应(g)+ I2(g) (g)+2HI(g),起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________,该反应的平衡常数Kp=_________Pa。 解析: 假设反应前碘单质与环戊烯均为nmol,平衡时环戊烯反应了xmol,根据题意可知;
得x=0.4nmol,转化率为0.4n/n×100%=40%;
Kp==3.56×104 例2. 2018年全国1卷28(节选)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
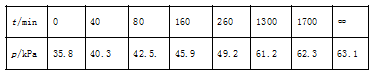
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
①已知:2N2O5(g)2N2O4(g)+O2(g) ΔH1=−4.4 kJ·mol−1 2NO2(g)N2O4(g) ΔH2=−55.3 kJ·mol−1 则反应N2O5(g)=2NO2(g)+O2(g)的ΔH=_______ kJ·mol−1。 ②研究表明,N2O5(g)分解的反应速率。t=62 min时,测得体系中=2.9 kPa,则此时的=________kPa,v=_______kPa·min−1。 ③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。 ④25℃时N2O4(g)2NO 2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。 解析: ①已知: ⅰ、2N2O5(g)=2N2O4(g)+O2(g) △H1=-4.4kJ/mol ⅱ、2NO2(g)=N2O4(g) △H2=-55.3kJ/mol 根据盖斯定律可知ⅰ÷2-ⅱ即得到: N2O5(g)=2NO2(g)+1/2O2(g) △H1=+53.1kJ/mol; ②根据方程式可知氧气与消耗五氧化二氮的物质的量之比是1:2,又因为压强之比是物质的量之比,所以消耗五氧化二氮减少的压强是2.9kPa×2=5.8kPa,则此时五氧化二氮的压强是35.8kPa-5.8kPa=30.0kPa,因此此时反应速率v=2.0×10-3×30=6.0×10-2(kPa·min-1); ③由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高,所以若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)大于63.1 kPa。 ④根据表中数据可知五氧化二氮完全分解时的压强是63.1kPa,根据方程式可知完全分解时最初生成的二氧化氮的压强是35.8kPa×2=71.6kPa,氧气是35.8kPa÷2=17.9kPa,总压强应该是71.6kPa+17.9kPa=89.5kPa,平衡后压强减少了89.5kPa-63.1kPa=26.4kPa,所以根据方程式2NO2(g)N 2O4(g)可知平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6kPa-26.4kPa×2=18.8kPa,则反应平衡常数 电子版领取方式: 对话框回复“1208”即可获得 ▎编辑:化学姐 ▎标签:高中化学 ◆ 高中化学12月月考试卷(高一、高二) 返回搜狐,查看更多 |
【本文地址】