肿瘤疗效影像评价:传统标准与新标准综述 |
您所在的位置:网站首页 › iresist标准 › 肿瘤疗效影像评价:传统标准与新标准综述 |
肿瘤疗效影像评价:传统标准与新标准综述
|
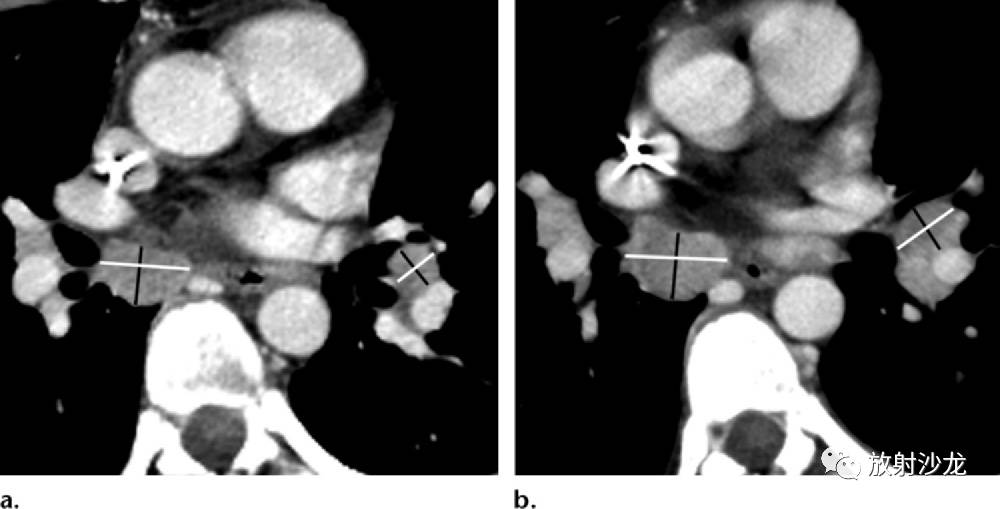
图1:根据WHO、RECIST 1.0和RECIST 1.1的标准,比较一个39岁女性乳腺癌患者的治疗效果。白线=最长直径,黑线=最长直径的垂直直径。 (a)轴向CT显示两个转移淋巴结。WHO标准采用SPD;RECIST 1.0采用所有靶病变的SLD;RECIST 1.1采用淋巴结的最短直径和靶病变的最长直径。在这个基线研究中,SPD = 455, RECIST 1.0 SLD = 35 mm, RECIST 1.1 SLD = 28 mm。 (b)随访CT显示淋巴结增大了几毫米,SPD 增大到569 (25%的改变), RECIST 1.0 SLD 增加到39 mm (11%的改变), RECIST 1.1 SLD增加到 33 mm (18%的改变)。根据这些测量,以WHO标准分类,治疗效果归类为疾病进展,以RECIST 1.0和RECIST 1.1的标准归类为疾病稳定。因为淋巴结短径增加超过了长径的增加,RECIST 1.0和RECIST 1.1的SLD有7%的差异。在这个病例中可以看到,治疗效果分类根据不同标准会有不同。因为WHO标准是使用直径的乘积,它的缺点是对肿瘤大小或测量误差的较小改变过于敏感。RECIST 1.1对靶淋巴结增加了要求,短轴直径必须至是15mm。 RECIST 标准 2000年,世界卫生组织,美国国家癌症研究所和欧洲癌症研究和治疗组织提出了新的RECIST标准(3)。旧的RECIST标准(RECIST 1.0版本)很大程度上基于一项临床试验的回顾性统计评估获得的结果,该试验由8个制药商赞助,纳入了569个病人(4)。RECIST标准已经被学术机构、监管部门和制药企业采纳,其主要的终点是预期疗效或进展。旧版RECIST标准的主要特点包括可测量病变最小尺寸的定义、仅用单径线测量(例如,最长直径)及新的成像技术使用细节(如螺旋CT)。疾病进展定义为出现新病变或最小SLD增大超过20%(对比WHO标准为增大超过25%)(图1)。此外,可疑的病变必须明确,才能诊断疾病进展。
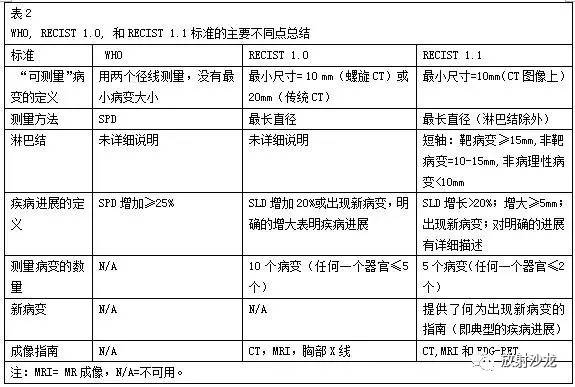
RECIST 1.1 引入旧版的RECIST标准后出现了一系列问题,包括淋巴结的评估和新的成像技术的应用,例如多排螺旋CT和MR。RECIST工作组通过修改2009年的标准来解决这些问题(5)。RECIST 1.1版本的建立基于对超过6500名患者的更大数据库的分析(6)。 测量方法 新的标准有一些修改和补充,如表2所列。除了淋巴结用最短径来定义病理性增大外,所有靶病变必须测量最长径。可测量的靶病变最长直径必须至少为10mm、可测量的淋巴结的短径必须至少为15mm(图2a)。最长值径小于10mm的病变或短径小于15mm的淋巴结不被认为是靶病变。大多数测量是在轴位图像进行,但是一些肿瘤(如椎旁病变)可以在冠状位或失状位测量,前提是CT重建是各向同性的或者图像是MR图像。(图2b)。 对于评估溶骨性或溶骨-成骨混合性的骨骼病变,推荐采用CT或MR测量病变的软组织成分,只要这些成分满足前面所描述的标准。成骨性病变被认为不可测量。实性病变而不是囊性病变被推荐为靶病变。除非有病变大小的改变,位于此前放疗区域的靶病变不被认为可测量。
图2:根据 RECIST 1.1 选择和测量靶病变。 (a)靶病变的数量和大小。女,57岁,转移性黑色素瘤史,轴位对比增强图显示脾脏有三个转移灶,门静脉周围和脾动脉后方有三个转移性淋巴结。根据RECIST 1.1 ,测量每个脏器两个最大、边界最清楚的病变的最长直径(脾脏中的两条长线);肝门的两个最大的结节为可测量的病变,因为它们最短轴(两条短线)超过15mm。位于胰腺后(箭头所指)的第三个淋巴结短轴测量为9mm,因此,根据RECIST 1.1标准不能作为靶病变。 (b)测量平面。女,56岁,失状位MR T2加权图显示C2到C6颈髓内肿块。肿块的最长直径在失状位测量而不是在轴位测量。RECIST 1.1允许失状位或冠状位MR图像用于靶病变测量。如果CT重建图像为各向同性,RECIST 1.1也接受在CT冠状位或失状位图像测量这些病灶。 (c)不可测量病灶VS可测量病灶。一位66岁乙状结肠腺癌转移的患者,冠状位对比增强图示腹膜转移(箭头)及肝胃韧带处淋巴转移(线)。腹膜病变边界模糊且常常被大量的腹水遮蔽(A),在随访图像中很难准确测量病灶大小,因此,这些病灶被认为是不可测量的。肝胃韧带的淋巴结只要满足适当的选择标准可作为靶病变。 (d)一位67岁的盲肠浸润癌患者,轴位CT示肠壁的环形肿块(箭头)。原发灶不应作为靶病变,因为它起源于中空器官且它的最长直径不能在轴位图像定义,使其不可测量。 (e)融合病变。女,43岁,卵巢癌患者,轴位对比增强图示低密度肝转移灶。在之前的研究中两个最大的病变被选为靶病变,然而,它们有进展且彼此相邻。根据RECIST 1.1指南,这两个病灶仍应分开测量其最长直径(线),因为它们之间有清晰的分界(箭头)。这个分界允许在最长轴测量病灶。如果这两个病灶完全融合且不能分开,则应测融合病灶的最长直径。 疾病进展的评估 在基线评估中,最多五个病变(在任意器官中至多两个病变)被确定为靶病变。如果最大的病变不适合重复测量的话,则选择下一个可被重复测量的最大病变(图2c,2d)。所有靶病变的SLD均需测量(非淋巴结病变测量长径,淋巴结测量短径),并作为基线值。这个基线值被用来作为一个参考来评估肿瘤在未来某个时间点的客观反应。所有其他病变(或病变的位置),包括病理性淋巴结,都应认定为非靶病变,其有无应记录在基线评估中。 靶病变和非靶病变的评估 靶病变(包括淋巴结)如果变得“太小而难以测量”,仍应测量并在后续的评估中记录其有无。每个淋巴结的短径必须小于10mm,才符合完全缓解。如果非淋巴结病变呈分散碎片状,那么每一部分的最长径应该累加起来计算靶病变的最长径。同样,融合病变,在病变之间应该有个界面来帮助确定每个病变的最长直径(图2e)。如果两个病变完全融合且不能分开,最长直径应该是融合病变的最长径。 新病灶的出现提示疾病进展,因此,对这些病变进行评价是很重要的。然而,新病变的发现应该是明确无误的,而不是归因于不同的扫描技术、成像手段或别的不是肿瘤的发现。可疑的新病变(如太小而无法测量的病变)应该在后续的检查中重复评估,以确定他们是否真正代表新病变。有时候联合采用FDG-PET用于评估可能的新病变是合理的。 如果在随访过程中非靶病灶出现变化,定性为疾病进展需要有显著恶化的征象,目的是即使在疾病稳定或部分缓解的情况下,医生也会考虑有必要改变治疗方案。 成像方面的考虑 RECIST 1.1推荐维持标准图像采集参数,目的是为了不同研究之间的最佳对比。CT的层厚应该小于等于5毫米。胸部、腹部和盆腔的CT应该在感兴趣的整个解剖区域中连续扫描。为了检测出可能的新病灶,随访研究应该涵盖已知原发肿瘤可能发生扩散转移的所有领域。应特别注意静脉注射对比剂的剂量和注射速率应当一致。大多数实体肿瘤可能在注射对比剂后用单期扫描。多期CT扫描对提高一些富血供肿瘤的显示率是非常必要的(如肝细胞或神经内分泌肿瘤)。 与CT相比,核磁成像提供了优越的软组织对比、空间和时间分辨率,但也更昂贵和并有更多限制。核磁成像中包含许多图像采集变量,这可能影响病变的清晰显示和测量。因此,在基线和随访检查时,相同的核磁成像设备应该使用相同的图像采集方案。 鉴于超声评价具有主观性和操作者依赖性,在临床试验中测量肿瘤复发或进展不应使用超声波检查。 采用胸部平片测量被周围肺实质包绕的病灶是可以接受的,但不是首选,因为平片上病灶的密度是一个叠加的密度。鉴于胸部平片检测病变的敏感性较低,胸部CT是首选方法。 时间点疗效 临床试验中,对疾病稳定、肿瘤进展或进展的时间进行评估时,修订版RECIST指南非常有用。修订版RECIST指南认为,基于新的影像学征象评估疗效,应该在每个随访检查中使用(表3)。新的整体疗效的分类由靶病灶,非靶病灶以及新发病灶决定。例如,一个病人在治疗过程中可能在第一个随访检查中符合部分缓解状态,在第二个随访检查中是疾病稳定的状态。然而,如果一个新的病灶出现在随后的研究中,其状态将变为疾病进展。最好的整体疗效定义为在所有时间点上都有最好的疗效。
RECIST标准的局限性 虽然RECIST标准已被广泛使用,对使用肿瘤大小变化作为唯一标准的担忧,即使在RECIST 1.1中也尚未完全解决。CT测量的可靠性研究发现,肿瘤大小测量常常是不一致的(7、8)。一项研究中,两个阅片者测量数据之间的差异足以导致误分类,其错误率在疾病进展中高达29.75%,在肿瘤部分缓解中为13.75%,(7)。即使同一观察者的重复测量也有显著差异, 对疾病进展潜在的误分类率为9.5%,部分缓解潜在的误分类率为3%。对边缘模糊及不规则的病变 (如骨髓疾病),难以界定其边界,应用RECIST标准评价肿瘤疗效也可能有限制。 癌症靶向治疗中肿瘤疗效的标准 癌症靶向治疗是使用药物通过干扰涉及肿瘤生长和进展的特定分子从而阻断肿瘤的生长和扩散。在过去十年里这些药物大大改变了治疗癌症的方式。美国食品和药物管理局已经批准了许多癌症靶向疗法来治疗特定类型的癌症。靶向治疗的作用机制不同于传统的细胞毒性化疗(图3)。一些药剂可以诱导细胞凋亡,而一些药物可以阻止病变进展。因为作用机制不同, 靶向治疗的肿瘤不一定显示出与细胞毒性治疗的肿瘤相同的影像学征象(图4)(9)。因此,传统的基于解剖大小的标准可能会导致对肿瘤疗效的误分类,比如,使用靶向疗法治疗胃肠道间质瘤、肝细胞肝癌、黑色素瘤。
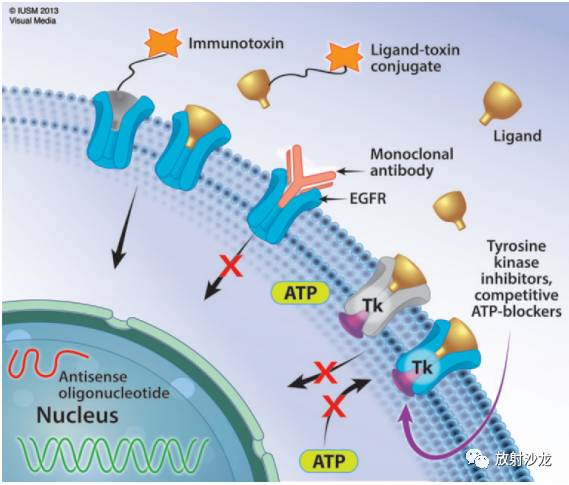
图3:癌症靶向治疗的作用机制。癌症的靶向治疗以多种方式干扰癌细胞的增生与扩散。 许多此类治疗方法都针对参与细胞信号通路的蛋白质。细胞信号通路是一个复杂的通信系统,其控制细胞的基本功能和活动,比如细胞分裂、细胞运动、对特定外部刺激的细胞反应,甚至细胞死亡。美国食品和药品管理局已批准近40种靶向治疗药物,目前许多其他药物也正在进行临床试验。这些药物中,抑制酪氨酸激酶(Tk)的药物有伊马替尼和舒尼替尼。单克隆抗体包括曲妥珠单抗和帕妥珠单抗,能够与人类表皮生长因子受体(EGFR)2 上的HER-2蛋白结合。另一种单克隆抗体是贝伐单抗,能够与血管内皮生长因子受体结合。ATP(三磷酸腺苷)。
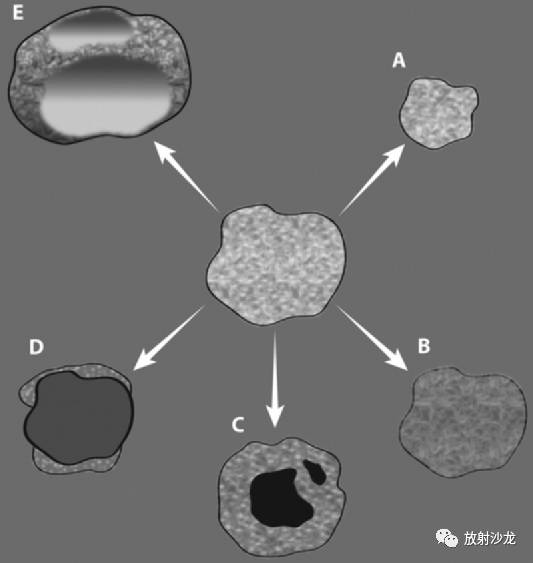
图4:靶向治疗的不同疗效。能够观察到的靶向治疗的疗效与常规化疗的疗效不同,包括病变大小的减少(A),病变血管数减少伴或不伴显著大小变化(B),大小不变或减少但伴有空洞现象(肺肿瘤)(C),囊变伴或不伴大小减少(D),肿瘤内出血伴或不伴大小改变 (E)。 Choi标准 直到伊马替尼出现以前,进展性胃肠道间质瘤的治疗选择都是有限的。伊马替尼是一种竞争性酪氨酸激酶受体拮抗剂,已经展示出非凡的功效。在使用伊马替尼治疗的过程中,肿瘤的大小通常是减少的;然而,肿瘤尺寸的变化不一定反映肿瘤的疗效 (图5)(10,11)。在某些情况下,肿瘤大小可以增加,比如肿瘤继发内部出血,坏死或黏液样变性。在治疗后的早期阶段,肿瘤大小的减少通常是最少的,反而在内部特征上会出现剧烈变化(例如肿瘤密度,瘤内结节和血管的数量)。在伊马替尼治疗,Choi标准提出肿瘤密度变化可以提供额外的疗效测量数据。这种疗效在治疗很早期就可以观察到(10)。
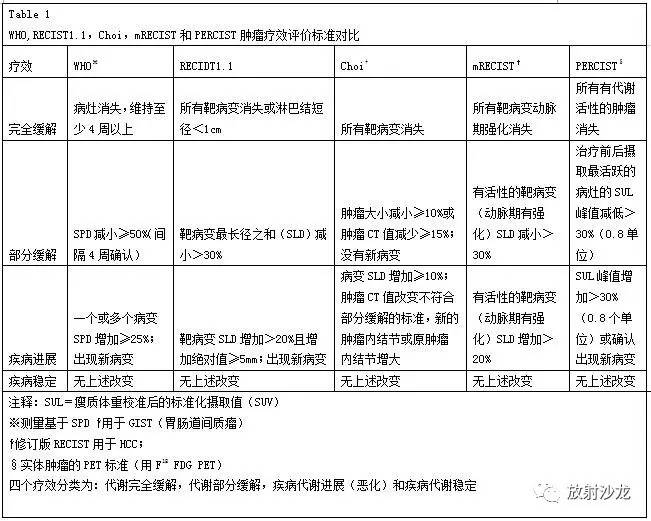
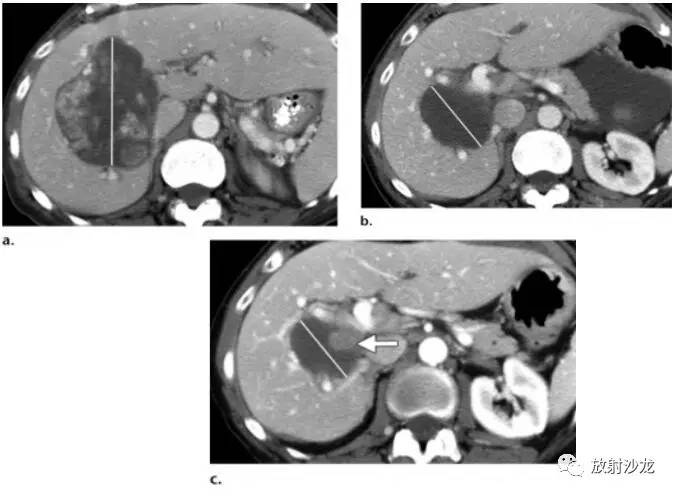
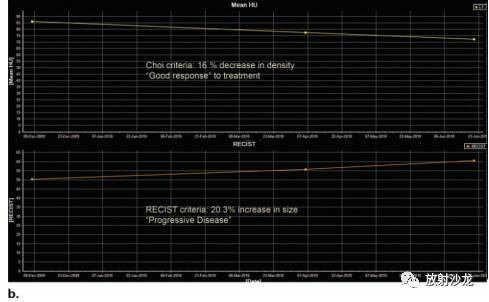
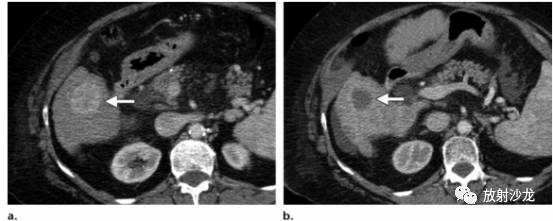
图5.根据肿瘤大小标准来评估用于稳定疾病的新的癌症治疗方案的局限性。 (a)一位60岁女性,有转移性GIST病史,轴位对比增强基线CT图像示最大转移灶位于肝右叶,内部有结节样强化,把这一病灶作为靶病灶,测量其最大径(直线)。(b)靶向治疗后增强CT示:肿瘤最大径与基线图像相比缩短38%。根据RECIST及Choi标准,疗效都可以评估为部分缓解。此外,肿瘤的平均密度下降了61%。(c)随访CT图像显示肿瘤的大小进一步减小(比基线图减少了49%)。然而,在肿瘤内部有新发增强结节(箭),这应当视为疾病复发。根据RECIST标准,因为没有考虑瘤内形态改变,这种情况仍然会归类为部分缓解。但是另一方面,根据Choi标准,肿瘤密度和肿瘤大小都会测量,新的肿瘤密度增加(由于增强结节)会被正确地归类为疾病进展。 对于伊马替尼治疗的转移性胃肠道间质瘤患者, PET检测早期疗效高度敏感,同时也有助于预测长期疗效(12)。基于整体肿瘤负荷、CT值的疗效和FDG-PET中最大SUV(SUVmax)有很好的相关性(10)。不过,PET的实用性仍然是有限的,在高达21%的患者中,治疗前葡萄糖摄取不足而不能被FDG-PET检测出来(10)。在一项试图用CT更好评价疗效的研究中,部分缓解状态被重新定义为FDG-PET中SUV的下降(<70%的基线值或者SUVmax<2.5)(12)。在所有FDG-PET能够观察到疗效的患者中,伊马替尼治疗8周后的CT上,97%的患者肿瘤大小会有至少10%的减少,或者肿瘤密度会有至少15%的减少(11)。在这些研究结果的基础上,新的标准结合了肿瘤密度(减少≥15%)或肿瘤大小变化(减小≥10%)来评估部分缓解。另外一个与RECIST标准的重要区别是:如果根据肿瘤密度不符合部分缓解的标准(表1),疾病进展则被定义为SLD至少增加10%。这些修订的CT标准被证明有助于判断治疗是否有效,并且对于无进展生存(PFS)提供了一个上佳的预后指标(13)。在引入Choi 标准之前,肿瘤复发或者进展根据肿瘤大小增加以及在局部或者远隔发现新的病灶来诊断。在GIST中,肿瘤大小的增加仍然是重要的,然而,肿瘤复发可以在治疗后呈低密度的瘤内发生,但不伴有肿瘤大小的改变(图6)(14)。
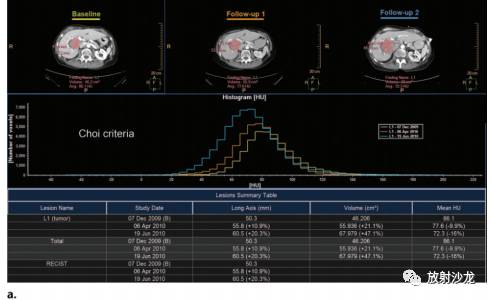
图6.Choi 与RECIST标准在评估一例经伊马替尼靶向治疗的60岁转移性GIST患者疗效的对比 (a)多模态肿瘤示踪软件Intellispace Portal(飞利浦医疗,Best,荷兰)屏幕截图显示了在治疗过程中三次CT检查(一个基线扫描,两个随访扫描)肿瘤密度和大小的纵向比较。对于每一次扫描,肿瘤均经半自动分割(红线)以测量它的密度和最长径线。根据Choi标准,HU值代表肿瘤密度,用直方图来表示。每一个直方图纵轴表示体素的数量,横轴表示肿瘤的密度。注意肿瘤大小的增加(体素数目的增加)和平均密度的减少(直方图均值左移)(Jeffrey H. Yanof ,PhD提供)。 (b)根据Choi标准,线图(上图)显示肿瘤密度平均值随时间的变化,以及根据RECIST标准,线图(下图)显示肿瘤大小随时间的变化。在RECIST图中显示,肿瘤大小在基线检查基础上增加(基线检查50.3mm vs最近期的检查60.5mm [增加20.3%])。根据RECIST标准,肿瘤大小增加超过20%被认为是疾病进展。治疗过程中,GIST大小增加可能继发于内出血、坏死或者粘液样变。平均HU值图显示从基线至其后的随访检查肿瘤密度进行性减少(86.1vs72.3HU[减少16%])。根据Choi标准,肿瘤密度减少15%或者更多被视为部分缓解。此例,用RECIST标准将会低估肿瘤治疗的疗效。 已经有研究试图用Choi疗效标准来评估其他实体性肿瘤。最近一项研究发现,Choi标准可能有助于评价舒尼替尼治疗的早期转移性肾细胞癌,但是使用该标准没有改变病人的治疗方案(15)。一项初步研究显示,在评估软组织肉瘤放化疗疗效方面,Choi标准优于RECIST标准。然而,需要更多研究对Choi标准的应用进行评价。 修订版RECIST标准 当用靶向治疗(如索拉非尼),或者介入治疗肝癌时,单纯根据肿瘤大小改变评估疗效也会导致错误的判断(17-19)。在2000年,一个由欧洲肝脏研究协会召集的肝癌专家小组建议,对比增强影像是评价存活肿瘤疗效的最佳方法(20)。新的标准,即修订版RECIST(mRECIST),随即被美国肝脏疾病研究协会所支持认可(21)。“存活肿瘤”定义为在CT或者MRI成像动脉期能够摄入对比剂的部分(表1),在这种定义基础上,动脉期所有靶病灶强化程度消失被认为是完全缓解(图7)。
图7.一例非酒精性脂肪性肝炎相关性肝硬化合并肝癌的76岁女性患者使用mRECIST和RECIST的对比。 (a)轴位对比增强动脉期CT图像显示:肝右叶3.2cm富血供肿瘤(箭),该患者经动脉接受了钇90玻璃微球治疗(ThersaSphere;Nordion,Ottawa,Ontario,Canada)。 (b)介入治疗后6周,动脉期CT图像显示:肿瘤富血供特征消失(箭),根据mRECIST标准,符合CR(完全缓解)。根据mRECIST,“存活肿瘤”定义为CTMRI图像显示动脉期能够摄取对比剂的部分。而另一方面,根据RECIST标准,肿瘤大小由3.2cm降至2.5cm(缩小了22%)符合SD(病变稳定)。在评估肝癌时,保证每次CT检查动脉期扫描时相一致很重要。mRECIST要求优化采集图像的方案,并且在所有随访检查中采用相同方案。 新的指南强调优化图像采集方案及所有随访检查中采集方案的一致性(18)。患者随访可以采用对比增强螺旋CT成像或者对比增强MR成像。不管用哪种成像方式,肝脏必须采用双期成像。延迟平衡期成像可能有一定的作用,但不是必须使用的,只有当临床实践需要才使用。存活肿瘤应该在动脉期测量。靶病灶的选择应该根据RECIST标准关于可测量病灶的定义进行选择,需适合进行重复测量并在在动脉期有强化。对于浸润型肝癌如果肿块边界不清且不能够进行准确测量,那么就视为是非靶病灶。由于内部坏死的影响,存活肿瘤的最大直径会位于不同于基线测量的直径所在的平面。门静脉癌栓应视为不可测量的病灶,因为在治疗过程中血栓形成会掩盖真正的癌栓。新病变的存在代表病变进展。新病灶必须最大直径大于1cm,且动态增强成像具有HCC典型血供特征(即,动脉期明显强化,门脉期或静脉晚期对比剂洗脱),否则,新病灶则被认为是不明确的,需在随后的扫描中监测它的生长情况。 PERCIST 标准 尽管一系列因素与FDG摄取相关,但在大量研究中显示FDG摄取和癌细胞数目之间存在很强的相关性(22,23)。由于很多新的癌症治疗方法更倾向于细胞抑制而不是细胞杀伤,好的疗效可能主要与代谢减少有关,而肿瘤大小并没有明显缩小(图8)。因此,作为肿瘤疗效主要指标的代谢反应可能比形态学标准更加能预测结果。正是在这种背景下,2009年提出PERCIST标准以细化及确认用定量方法监测PET上的肿瘤反应。
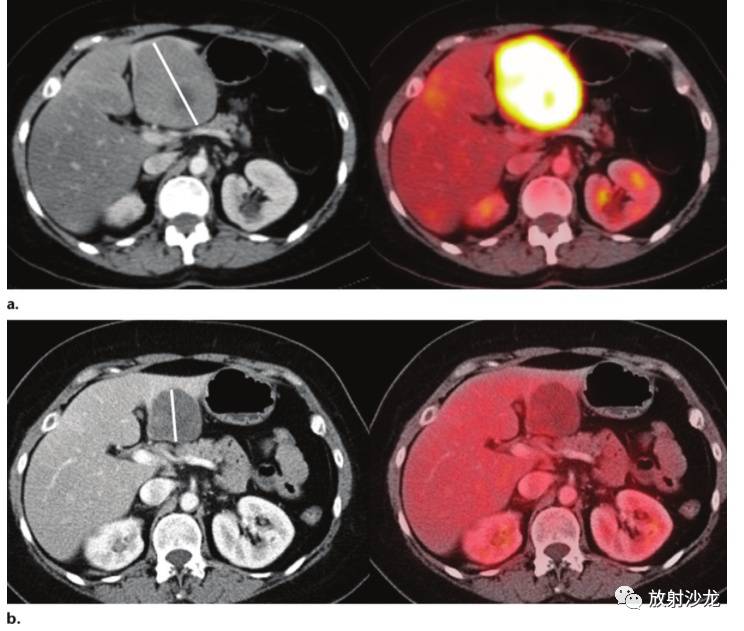
图8 一位胃肠道间质瘤转移经伊马替尼治疗后的女性患者,评估标准是根据PERCIST和RECIST。 a图示:患者治疗前左侧CT增强轴位图和右侧PET/CT融合轴位图显示,肝脏左叶一直径7.2cm FDG高亲和性肿块。 b图示,治疗后2个月,CT增强和PET/CT轴位图显示,肿块明显缩小至直径4.3cm(CT图直线所示)且肿块内未见明显代谢活动。根据PERCIST,所有肿瘤的代谢活动消失被认为代表完全代谢反应。而RECIST不考虑肿瘤的代谢活动,导致这样分类的原因是部分缓解仅基于肿块大小的变化,继而引起治疗效果被低估。肿瘤治疗后两年没有复发且肿块大小没有继续缩小。 评估治疗带来的代谢改变存在两种基本的方法:定量和定性。因为读片者之间关于疗效定性可重复性报道的数据不,PERCIST优先采用定量方法。用PET对代谢性肿瘤疗效进行标准化定量评估需要一致且可靠的肿瘤活性测量方法。这要求相同的患者准备并且扫描质量从基线研究到随访研究基本相同,这需要使用同一设备、注射剂量相当的FDG及使用相当的摄取时间。与标准体重标准化SUV(SUVbw)相比,PERCIST推荐使用SUL(瘦体重标准化SUV [SUVlbm]),主要是因为SUL对患者体重的依赖性降低。由于使用广泛,SUL峰值是首选的方法,SUL峰值是在肿瘤最大摄取范围内取1cm3(或1.2cm直径大小)的定点感兴趣区域进行测量。通过严格限定感兴趣体积的尺寸和位置,可以减少测量误差,并且多个体素平均减少了对噪声的敏感性(图9)。PERCIST还建议同一患者以肝脏活性作为参考标准来研究不同次检查SUL的误差变化。另外,通过规定SUL的误差必须低于20%(即0.3 SUL平均单位),多个时间点PET定量的非病理性变化所致影响会减少。PERCIST建议最后一次化疗与接下来的FDG-PET检查的时间间隔至少10天。还建议外照射放疗后的时间间隔更长和更加可变(8-12周)。 根据PERCIST, 疗效作为一种连续变量被评估,并且用治疗前后PET/CT每个时间点最活跃病变的SUL峰值的百分比变化表示(表1)。完全代谢缓解定义为所有肿瘤肉眼可见的代谢活性消失。代谢部分缓解定义为治疗后活性最强病灶比治疗前活性最强病灶的SUL峰值下降0.8单位(>30%),注意治疗前后活性最强病灶不一定是同一病灶。SUL峰值增加大于0.8单位(>30%)或者出现新发病灶则认为是疾病代谢进展。对于测量多少个病灶没有明确规定。虽然基于单个靶病灶的疗效,PERCIST具有特异性的标准,但是建议找另外5个病灶的数据,以便建立数据库便于将来的研究。 PET/CT扫描方案的标准化是至关重要的,其特点包括注射剂量、注射后延迟、重建参数和SUV标准化技术及其它变量的一致性。 在不同PET中心及对不同肿瘤类型进行标准化成像存在困难。再加上对相关治疗评估的时机存在不确定性,使用定量测量FDG摄取来评价疗效仍然存在困难。然而,越来越多的证据显示FDG-PET已经成为评估肿瘤疗效的一种临床技术,尤其是在有FDG有亲和性的淋巴瘤亚型中。
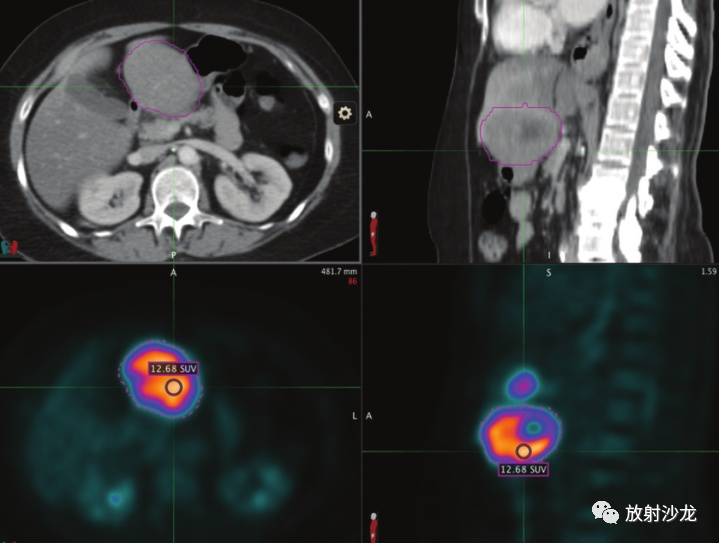
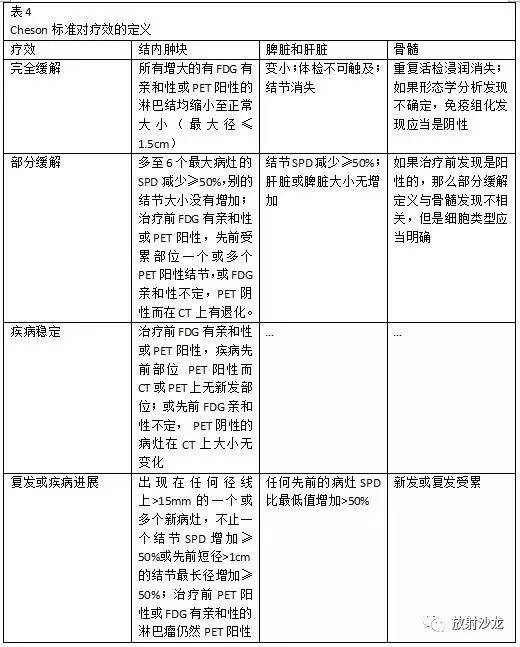
图9 使用肿瘤示踪软件测量SUV。轴位CT增强图像(左上)和失状位图像(右上)及对应的PET图像显示使用肿瘤示踪软件(MIM Software, Cleveland, Ohio)测量SUV(下图)。肿瘤的边界通过半自动的方法以紫色勾边。在所选最高代谢活性的区域中选择1cm3感兴趣区(PET图像上的圆圈)并测得SUV峰值。用标准方案选择感兴趣区是SUV测量可重复性的关键。 恶性淋巴瘤的Cheson疗效标准 淋巴瘤是另外一种有具体肿瘤评估标准的疾病。由于该疾病特定的复杂性,仅以大小随时间的变化评估疾病也不能准确反应疾病的状态(25)。由于残余的纤维化和坏死,根治性治疗后,肿块常常不能完全退化。这种大小方面的稳定性不一定代表存活的肿瘤。 Cheson疗效标准制定于1997年,修改于2007年。Cheson疗效标准允许在治疗过程中分析肿瘤的大小和代谢活性。2007年的修订包括了治疗进展和以图像为基础的评估方面的进展。1997版和2007版主要区别在于以下两点:a、停止 Ga(镓)闪烁显像而支持采用PET成像(反映了后者在评估肿瘤疗效方面的广泛优势);b、包括了流式细胞术和免疫组化的评估(表4)。 为了肿块测量的一致性,建议测量多达6个主要淋巴结或肿块的SPD。达到部分缓解状态,这些靶向病灶的活性需至少减少50%。判定病变复发或病变进展所需的新的靶病灶的截值为1.5cm(淋巴结短轴1cm)。只要肿块PET显示呈阴性,肿块治疗后没有消失或大小随时间减小都认为是完全缓解。
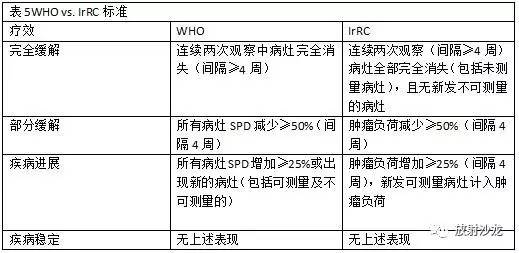
免疫相关疗效标准 WHO和RECIST指南认为,治疗早期肿瘤增大或出现新的病灶代表疾病进展,细胞毒性药物应停止使用。然而,在免疫制剂(例如,易普利姆玛)的研究中,临床经验发现即使肿瘤负荷增加的情况下,免疫制剂的使用也能达到完全缓解、部分缓解及疾病稳定状态。因此,传统的疗效标准可能不能充分评价免疫制剂的活性。在病变真正进展及免疫制剂撤下之前,那些病变稳定和实验数据未见明显恶化的患者必须再次复查影像进行确认(27)。 在2004-2005年,癌症疫苗联合会与国际癌症生物治疗协会合作举办了一系列国际研讨会,建议增订 WHO标准,认可免疫制剂独特疗效模式的评估标准(28)。随后,免疫相关疗效标准(IrRC)在易普利姆玛(能够阻遏细胞毒性T淋巴细胞抗原-4的人类单克隆抗体)治疗的晚期黑色素瘤患者的临床试验中研究并制定出来(27)。IrRC最重要的创新之处是将可测量的新病灶计入“肿瘤总负荷”这一新概念,并将这一变量与基线测量相比较。IrRC标准将靶病灶与可测量的新病灶均考虑在内。与传统的WHO标准相比,后者没有要求对新病灶测量,对肿瘤负荷增加进行描述时也没有纳入新病灶的测量。在基线肿瘤评估中,所有靶病灶的SPD均测量(单一器官可多至5个病灶;最多可有10个内脏器官靶病灶以及5个皮肤靶病灶)。在每个随后的时间点中,所有原先的靶病灶以及所有可测量的新病灶的SPD都合计为肿瘤总负荷。有了这个新的概念,肿瘤疗效分类对WHO标准做了修订(表5)。WHO与IrRC标准主要区别在于前者将出现新发可测量病灶定为疾病进展。而根据IrRC标准这些新发病灶未必代表疾病进展,也不一定会导致治疗中断。 虽然能够体现在免疫制剂发面相对于传统标准的改进,IrRC标准也面临自身的挑战;因此,更多的前瞻性评估是极其必要的,尤其是其与患者整体存活率的联系(27)。
未 来 趋 势 影像学将会继续不断适应与当前和未来靶向治疗制剂一致的新的肿瘤治疗概念。随着个体化医疗时代分子医学的出现,肿瘤学研究的终极目标是个体化、精细化特定肿瘤及特定患者的治疗方案。肿瘤疗效标准也应基于治疗和肿瘤类型选择。功能性生物标志物的应用,包括但不限于FDG-PET,对于确保影像学技术与肿瘤学新的治疗观点与时俱进是非常重要的。 时间会告诉我们肿瘤疗效标准是否会整合入日常的放射工作;然而,随着更多标准出现,其复杂性会使这种整合的可能性降低。现在,有很多商业性多模态肿瘤示踪软件,但目前这些软件还没有与当前临床上影像浏览工作站集成,而仅作为第三方解决方案单独出售。如果影像医师要将这些标准用于日常工作而不是进行临床试验,则需要简化的集成软件以及硬件解决方案。 References 1. World Health Organization. WHO handbook for reporting results of cancer treatment. Geneva, Switzerland: World Health Organization, 1979. 2. Miller AB, Hoogstraten B, Staquet M, Winkler A. Reporting results of cancer treatment. Cancer 1981; 47(1):207–214. 3. Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst 2000;92(3):205–216. 4. James K, Eisenhauer E, Christian M, et al. Measuring response in solid tumors: unidimensional versus bidimensional measurement. J Natl Cancer Inst 1999;91(6):523–528. 5. Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revisedRECIST guideline (version 1.1). Eur J Cancer 2009;45(2):228–247. 6.Bogaerts J, Ford R, Sargent D, et al. Individual patient data analysis to assess modifications to the RECIST criteria. Eur J Cancer 2009;45(2):248–260. 7. Erasmus JJ, Gladish GW, Broemeling L, et al. Interobserver and intraobserver variability in measurement of non-small-cell carcinoma lung lesions: implications for assessment of tumor response. J Clin Oncol 2003;21(13):2574–2582. 8. Zhao B, Schwartz LH, Moskowitz CS, Ginsberg MS, Rizvi NA, Kris MG. Lung cancer: computerized quantification of tumor response—initial results. Radiology 2006;241(3):892–898. 9. Zhao B, Schwartz LH, Larson SM. Imaging surrogates of tumor response to therapy: anatomic and functional biomarkers. J Nucl Med 2009;50(2): 239–249. 10. Choi H, Charnsangavej C, de Castro Faria S, et al. CT evaluation of the response of gastrointestinal stromal tumors after imatinib mesylate treatment: a quantitative analysis correlated with FDG PET findings. AJR Am J Roentgenol 2004;183(6):1619–1628. 11. Choi H, Charnsangavej C, Faria SC, et al. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: proposal of new computed tomography response criteria. J Clin Oncol 2007;25(13):1753–1759. 12. Van den Abbeele AD, Badawi RD. Use of positron emission tomography in oncology and its potential role to assess response to imatinib mesylate therapy in gastrointestinal stromal tumors (GISTs). Eur J Cancer 2002;38(suppl 5):S60–S65. 13. Choi H. Response evaluation of gastrointestinal stromal tumors. Oncologist 2008;13(suppl 2):4–7. 14. Hong X, Choi H, Loyer EM, Benjamin RS, Trent JC, Charnsangavej C. Gastrointestinal stromal tumor: role of CT indiagnosis and in response evaluation and surveillance after treatment with imatinib. RadioGraphics 2006;26(2):481–495. 15. van der Veldt AA, Meijerink MR, van den Eertwegh AJ, Haanen JB, Boven E. Choi response criteria for early prediction of clinical outcome in patients with metastatic renal cell cancer treated with sunitinib. Br J Cancer 2010;102(5):803–809. 16. Stacchiotti S, Collini P, Messina A, et al. High-grade soft-tissue sarcomas: tumor response assessment—pilot study to assess the correlation between radiologic and pathologic response by using RECIST and Choi criteria. Radiology 2009;251(2): 447–456. 17. Vossen JA, Buijs M, Kamel IR. Assessment of tumor response on MR imaging after locoregional therapy. Tech Vasc Interv Radiol 2006;9(3):125–132. 18. Llovet JM, Di Bisceglie AM, Bruix J, et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst 2008;100(10):698–711. 19. Forner A, Ayuso C, Varela M, et al. Evaluation of tumor response after locoregional therapies in hepatocellular carcinoma: are response evaluation criteria in solid tumors reliable? Cancer 2009;115(3):616–623. 20. Bruix J, Sherman M, Llovet JM, et al. Clinical management of hepatocellular carcinoma: conclusions of the Barcelona 2000 EASL conference. European Association for the Study of the Liver. J Hepatol 2001;35(3):421–430. 21. Bruix J, Sherman M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology 2005;42(5):1208–1236. 22. Bos R, van Der Hoeven JJ, van Der Wall E, et al. Biologic correlates of (18)fluorodeoxyglucose uptake in human breast cancer measured by positron emission tomography. J Clin Oncol 2002;20(2): 379–387. 23. Brücher BL, Weber W, Bauer M, et al. Neoadjuvant therapy of esophageal squamous cell carcinoma: response evaluation by positron emission tomography. Ann Surg 2001;233(3):300–309. 24. Wahl RL, Jacene H, Kasamon Y, Lodge MA. From RECIST to PERCIST: evolving considerations for PET response criteria in solid tumors. J Nucl Med 2009;50(suppl 1):122S–150S. 25. Jochelson M, Mauch P, Balikian J, Rosenthal D, Canellos G. The significance of the residual mediastinal mass in treated Hodgkin’s disease. J Clin Oncol 1985;3(5):637–640. 26. Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007;25(5):579–586. 27. Wolchok JD, Hoos A, O’Day S, et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res 2009;15(23):7412–7420. 28. Hoos A, Parmiani G, Hege K, et al. A clinical development paradigm for cancer vaccines and related biologics. J Immunother 2007;30(1):1–15. 点击阅读原文拥有自己的影像工作室返回搜狐,查看更多 |
【本文地址】