无细胞系统在CRISPR技术和生物传感器中的应用研究进展 |
您所在的位置:网站首页 › interacting翻译 › 无细胞系统在CRISPR技术和生物传感器中的应用研究进展 |
无细胞系统在CRISPR技术和生物传感器中的应用研究进展
|
图1无细胞系统的组成 无细胞生物传感器通常由检测对象、检测手段和信号输出组成,需优化系统稳定性和鲁棒性[32-33]。其中,检测手段的选择影响了检测对象的类别和信号输出的范围。目前,基于CRISPR/ Cas13的specific high-sensitivity enzymatic reporter unLOCKing (SHERLOCK)[21]、SHERLOCKv2[34]和heating unextracted diagnostic samples to obliterate nucleases (HUDSON)[35]技术已经显示出CRISPR/Cas系统在核酸检测方面的巨大潜力。以TXTL作为反应平台,将CRISPR传感器与生物材料结合,开发出基于纸张[22]和可穿戴式材料[36]的CRISPR生物传感器,便于实际应用;也可以与可编程的gRNA[26-28]和toeholdswitch[37]等工程化基因回路结合,使得传感器呈现布尔逻辑,易于调控。 因此,本综述聚焦TXTL与CRISPR技术的结合,首先整理了近年TXTL对CRISPR系统各部分的表征,然后对在生物传感器方面的应用进行归纳总结。最后,我们将讨论如何突破实验室仪器和专业人员的限制,拓展传感器应用场景,实现便携快速的即时检测(point-of-care testing, POCT)。 1 利用无细胞系统表征CRISPR/Cas系统 1.1PAM序列 1.2 gRNA的表征和设计改造
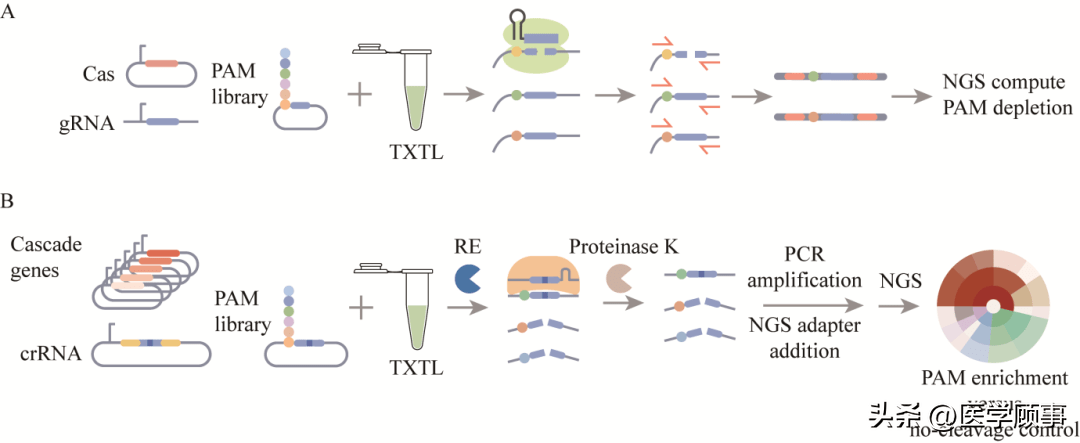
图2利用TXTL对PAM位点进行表征与筛选[9,41]
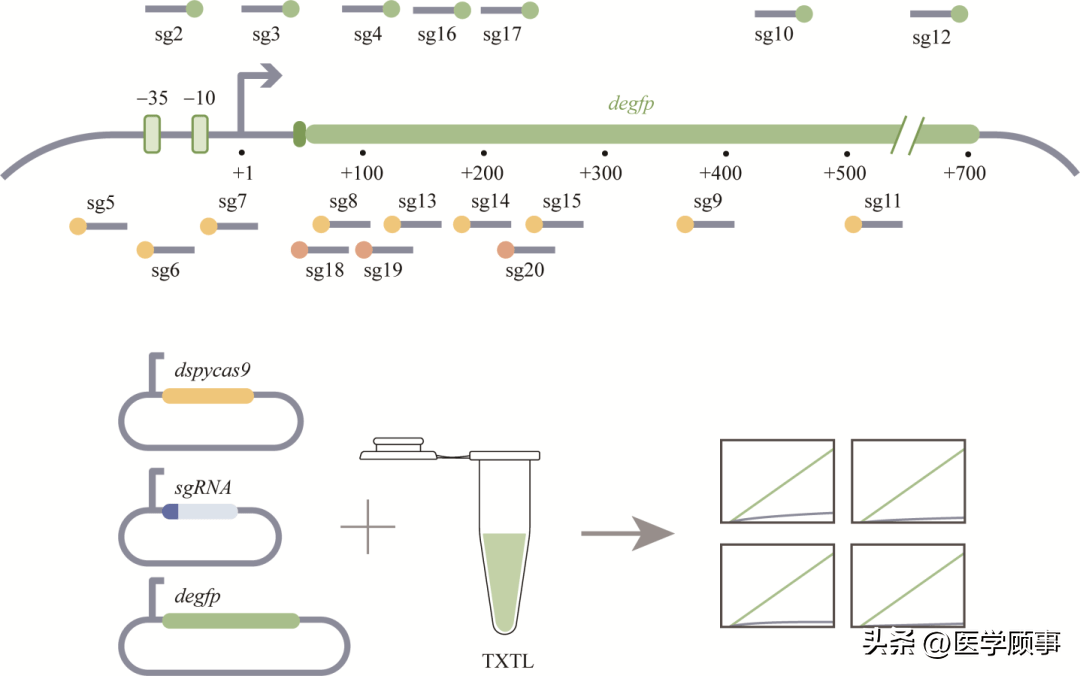
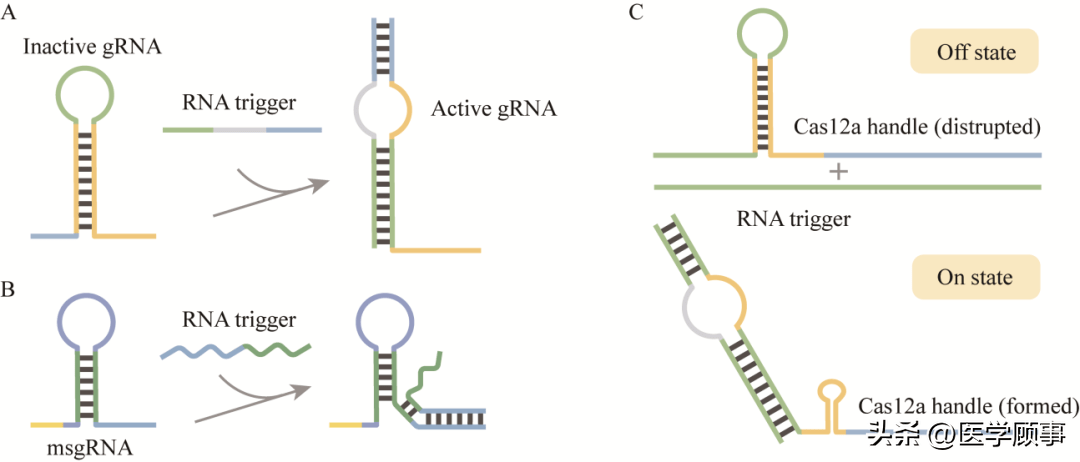
图3利用TXTL快速表征和筛选gRNA[9] 另外,为了实现对CRISPR系统的时序性调控,研究人员相继报道有关gRNA的设计方案。目前较为常见的是在gRNA/crRNA前的5′端或3′端添加序列后,将其改造成RNA/DNA响应的核酸开关。2018年,我国清华大学的Li课题组通过在单向导RNA (single guide RNA, sgRNA)的scaffold序列的第一个颈环和3′末端分别添加额外的序列,设计了一种与目标RNA杂交后才能与Cas9结合的sgRNA (mRNA-sensing gRNA, msgRNA)[28](图4A),可用作RNA传感器,实现了利用CRISPR/Cas9响应输出正交检测多个mRNA输入。2020年,英国华威大学的Jaramillo课题组提出了一种简单且长度更短的sgRNA设计(RNA-interacting guide RNA, igRNA)[26]。他们通过在sgRNA的5′末端添加额外序列,使spacer序列在无目标RNA的情况下呈双链状态,无法与靶标DNA结合,从而使需要特异性RNA序列激活的基因的靶向成为可能,并可应用于体外传感器和诊断工具的开发(图4B)。2021年,Beisel课题组改造了crRNA,使其成为可以响应不同核酸序列的gRNA开关(图4C),并用来检测在阿拉伯糖或铁离子存在的生长条件表达的内源性RNA,使Cas12的靶向活性依赖于细胞代谢和应激,从而使传感器与细胞状态绑定[27]。该设计具有普适性,也可以应用于分子检测、抗耐药基因等领域。得益于碱基互补配对原则,这些设计对目标序列具有高度特异性,但它们的灵敏度和最低检测限度仍有待探索。
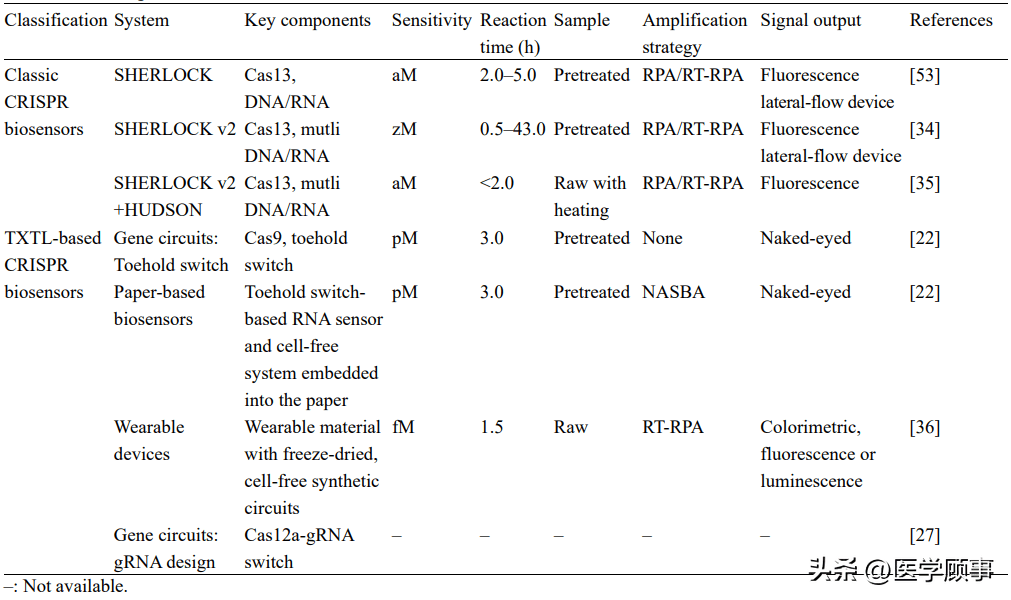
图4 gRNA被设计为核酸开关的不同方法[26-28] 1.3 Cas蛋白的表达 除了对CRISPR系统中单核酸酶进行表达之外,TXTL还实现了对多核酸酶的表达。比如,来自大肠杆菌K12品系的I-E型CRISPR/Cas系统(EcCascade)主要由8个cas基因(cas3、casA、casB、casC、casD、casE、cas1和cas2)和CRISPR阵列构成[45](图5)。CasA-E蛋白会组合成一个复合体cascade,结合crRNA沉默目标序列,并引导Cas3行使切割功能。相较于Ⅱ型系统,I-E型系统需要表达的蛋白更多,在胞内会更难表征[46]。但在TXTL中,Noireaux课题组将cascade序列基因克隆在T7启动子后即可实现表达。为了验证其功能,他们在体系中加入crRNA序列和靶向基因序列(P70a-deGFP)的质粒,实现了对目标基因的有效抑制,且抑制效果比Cas9更强[9]。 1.4 抗CRISPR蛋白的表达 抗CRISPR蛋白是噬菌体用以对抗细菌和古生菌CRISPR系统的蛋白。越来越多的CRISPR系统被发现意味着有更多的抗CRISPR蛋白,而不同的抗CRISPR蛋白抑制CRISPR系统的不同部分[30]。例如,一些抗CRISPR蛋白与Cas蛋白结合,阻断其靶向和结合DNA的能力,一些抑制Cas蛋白聚集潜在的新的间隔序列,还有一些与Cas蛋白结合,抑制其切割结合的目标DNA[29],进一步影响CRISPR系统调控基因和水平转移的能力[47-49]。但是目前发现的抗CRISPR蛋白缺乏明显的共性特征,这使得研究抗CRISPR蛋白变得更加困难。 图5 I-E型CRISPR/Cas系统的组成[45] 2 以无细胞系统为基础的CRISPR生物传感器 表1传统的CRISPR生物传感器与基于TXTL的CRISPR生物传感器性能比较
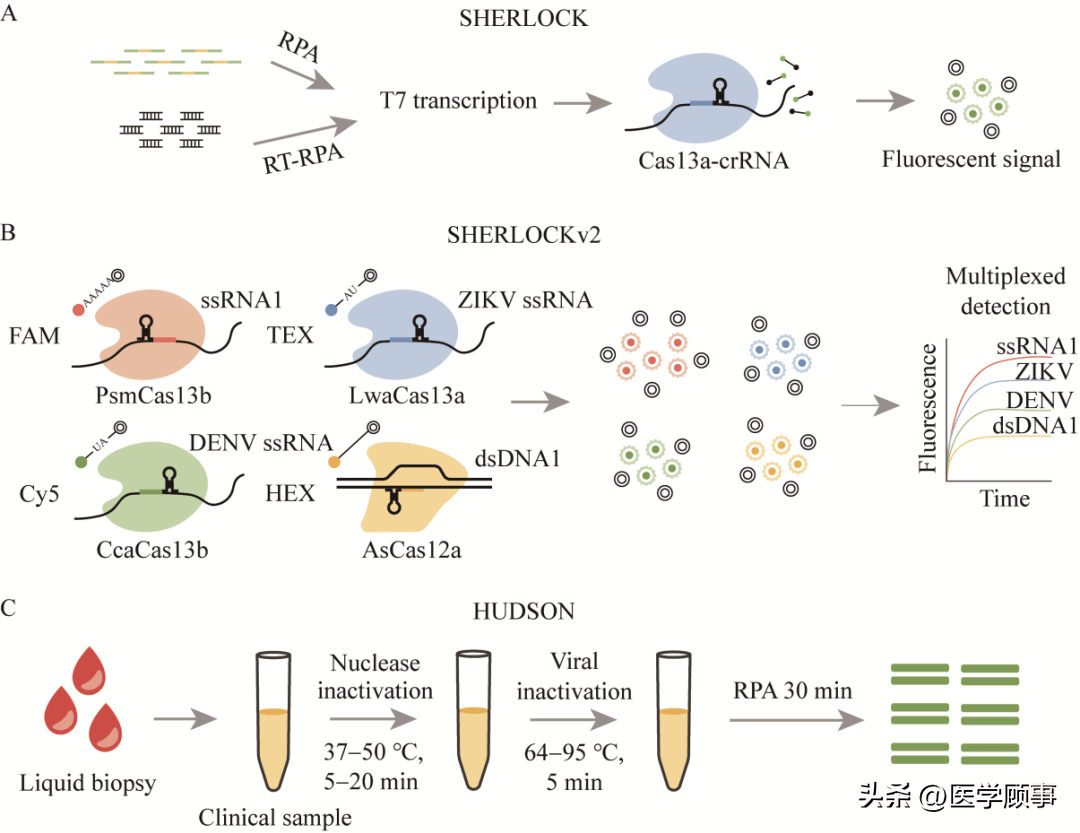
2.1 传统的CRISPR生物传感器 在核酸诊断中,CRISPR/Cas12和Cas13系统目前发展与应用较为成熟。Cas12a属于二类CRISPR/Cas Ⅴ型[54],其最大的特点是靶向目标双链DNA时,激活单链DNase活性,能够非特异、无差别地反式切割附近的单链DNA分子[55]。基于这种特性,在运用Cas12的生物传感器中大多引入了荧光报告基团和淬灭基团的报告单链DNA,当靶标激活Cas12a后,切割报告单链DNA,释放荧光信号,从而达到快速灵敏的核酸分子检测。Cas13与Cas12在切割原理上类似,但Cas13的靶标为RNA,因此,在检测RNA病毒方面有更多的应用。 SHERLOCK技术是一种基于CRISPR/Cas13的核酸检测技术[35,53],具有灵敏度高、反应快速的特点,能够检测寨卡[20]、登革热[35]、COVID-19[18]等病毒(图6A)。来自美国麻省理工学院的张锋课题组对该技术进行了优化并引入了4种不同的Cas酶(PsmCas13b、LwaCas13a、CcaCas13b、AsCas12a),根据其不同切割活性选择适配的荧光报告分子,从而实现了对多种类型病毒的同时检测,推出SHERLOCKv2技术[34](图6B)。麻省理工学院Sabeti课题组在开发SHERLOCK检测时引入HUDSON技术[35](图6C),仅通过简单的化学或预热处理,在裂解病毒的同时灭活被释放的核酸酶,减少了RNA提取的需要,不仅使样品处理更简洁,同时也提高了检测的便携度。
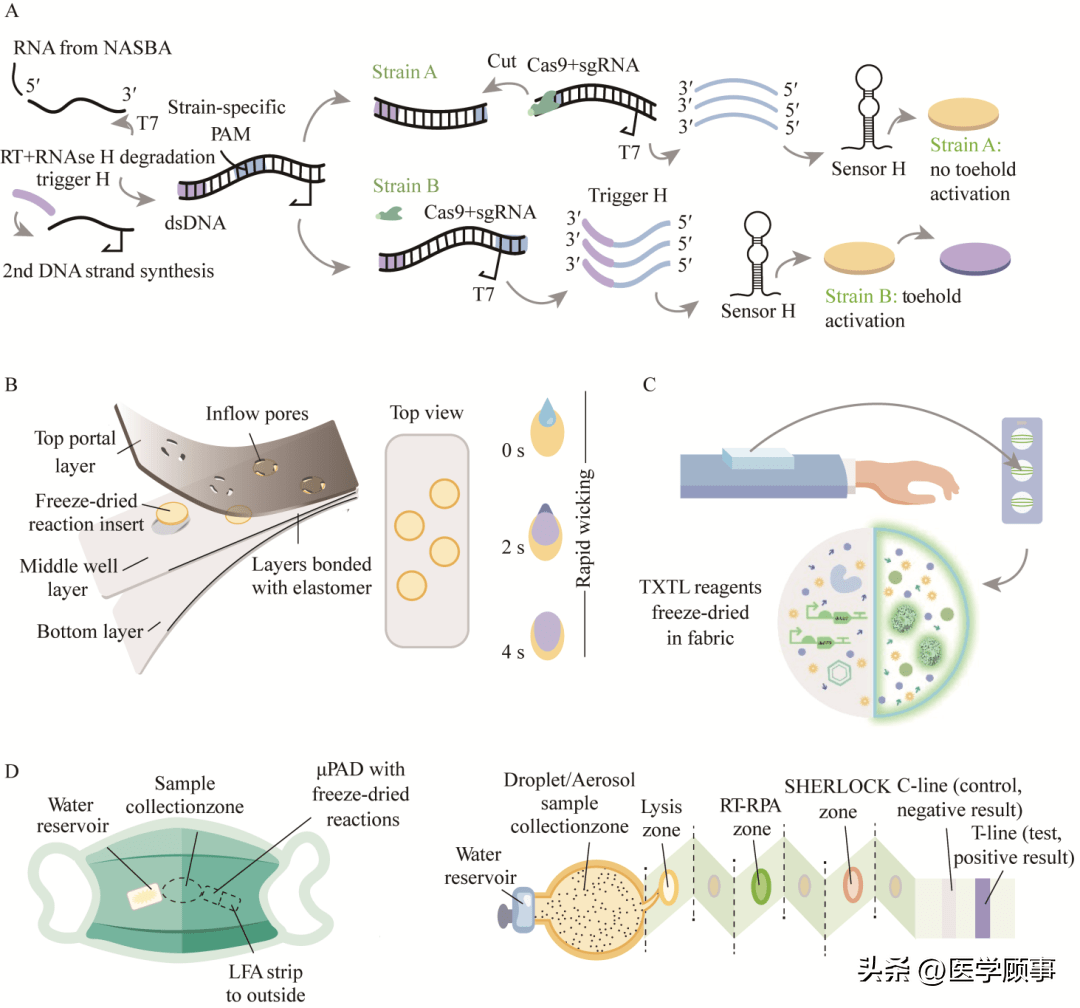
图6基于CRISPR/Cas13的传统生物传感器[22,34-35,51] 但是,目前基于SHERLOCK开发出的相关技术反应组分中需要蛋白质纯化和RNA的合成,这些实验操作增加了制备传感器的成本。此外,将传感器的反应混合物冻干,并在运输过程中维持其活性较难,目前尚未取得广泛的商业化[56]。因此,尽管CRISPR传感器核酸检测灵敏度高,在实际应用中仍缺乏合适的平台进行集成化的表达,TXTL作为体外合成蛋白质的平台,能够为CRISPR传感器的便携实地应用提供极大的便利。 2.2 与材料相结合的CRISPR无细胞传感器 随着CRISPR系统的生物传感器逐步发展,科学家们尝试将其运用到实际检测中,将TXTL试剂与表达CRISPR元件的核酸混合,冻干附于各种生物医学工程材料上,如纸质、可穿戴柔性材料,通过加入水激活传感器,更好地实现运输过程中的稳定和实地快捷方便的检测。早在2016年,美国麻省理工学院的Collins课题组将无细胞试剂附于纸面并冻干,提出了一种基于纸质传感器的核酸检测法[22](图7A)。利用响应寨卡病毒RNA的toehold switch[37]核糖开关,一旦目标RNA出现,toehold switch与其结合,释放RBS区域序列,触发lacZ基因的表达,水解试纸上的氯酚红-β-d-吡喃半乳糖苷(chlorophenol red mono-β-d-galactopyranoside, CPRG)底物,使试纸颜色由黄色变成紫色。由于toehold switch可以特异性检测RNA序列,因此试纸上的颜色变化能够辨别出寨卡病毒,甚至2种不同的寨卡病毒毒株,且灵敏度可达皮摩尔(picomolar, pM)级别。2021年,美国杨百翰大学的Bundy课题组开发出基于纸质的人类唾液SARS-CoV-2 RNA的核酸诊断平台,在无细胞反应体系中加入了小鼠RNA酶抑制剂(murine RNase inhibitor, mRI),使得在唾液状态下稳定反应,进一步提高了试纸即时检测的能力。并且他们利用NanoLuc生物发光报告基因使结果可视化,可用于快速和低成本的核酸检测[20]。 除此之外,将传感器整合到可穿戴设备中,可以扩大无创监测生理疾病状态、接触病原体和毒素的机会。2021年,Collins课题组开发了3种使用冷冻干燥后可穿戴的、基于无细胞系统的设备(wearable freeze-dried cell-free, wFDCF)[36]。第一种是将比色基因回路嵌入到由柔性弹性体制成的流体排芯和密封组件包围的纤维素基质中,通过毛细作用迅速吸进液体。使用lacZ作为基因回路的输出,其表达促进水解CPRG,使材料由黄色变成紫色(图7B)。第二种是将第一种传感器固定在可穿戴织物中,将电路的输出改为绿色荧光蛋白的荧光信号,通过嵌入的光纤对荧光蛋白进行激发和发射检测(图7C)。第三种是基于CRISPR/Cas12a SHERLOCK的可穿戴口罩传感器,由于咳嗽、说话或呼吸时病毒会在口罩内部聚集,因此该口罩携带有4个模块化组件:一个储存水的容器、一个大面积样品收集垫、一个用于微流控的分析装置(内含冻干的无细胞试剂)和一个横向检测试纸条。毛细作用可将液体和病毒颗粒洗到样品收集垫上,然后经过等温扩增,Cas12a SHERLOCK传感器检测和切割探针,最后在试纸条上显色(图7D)。使用时只需按下按钮,便可在穿戴条件下检测SARS-CoV-2,该口罩的检测灵敏度达到了飞摩尔(femtomolar, fM)数量级。这些设计展现出无细胞生物传感器在可穿戴材料和实际应用中的巨大潜力。 2.3 基因电路在CRISPR无细胞传感器中的应用 为了更好地扩展传感器的功能,许多研究引入了基因电路来更好地实现对信号的调控和不同条件下的响应,如非相干1型前馈回路(incoherenttype-1 feedforward loop, IFFL)、核酸开关(toehold switch)以及CRISPR系统中经编程改造后的gRNA。
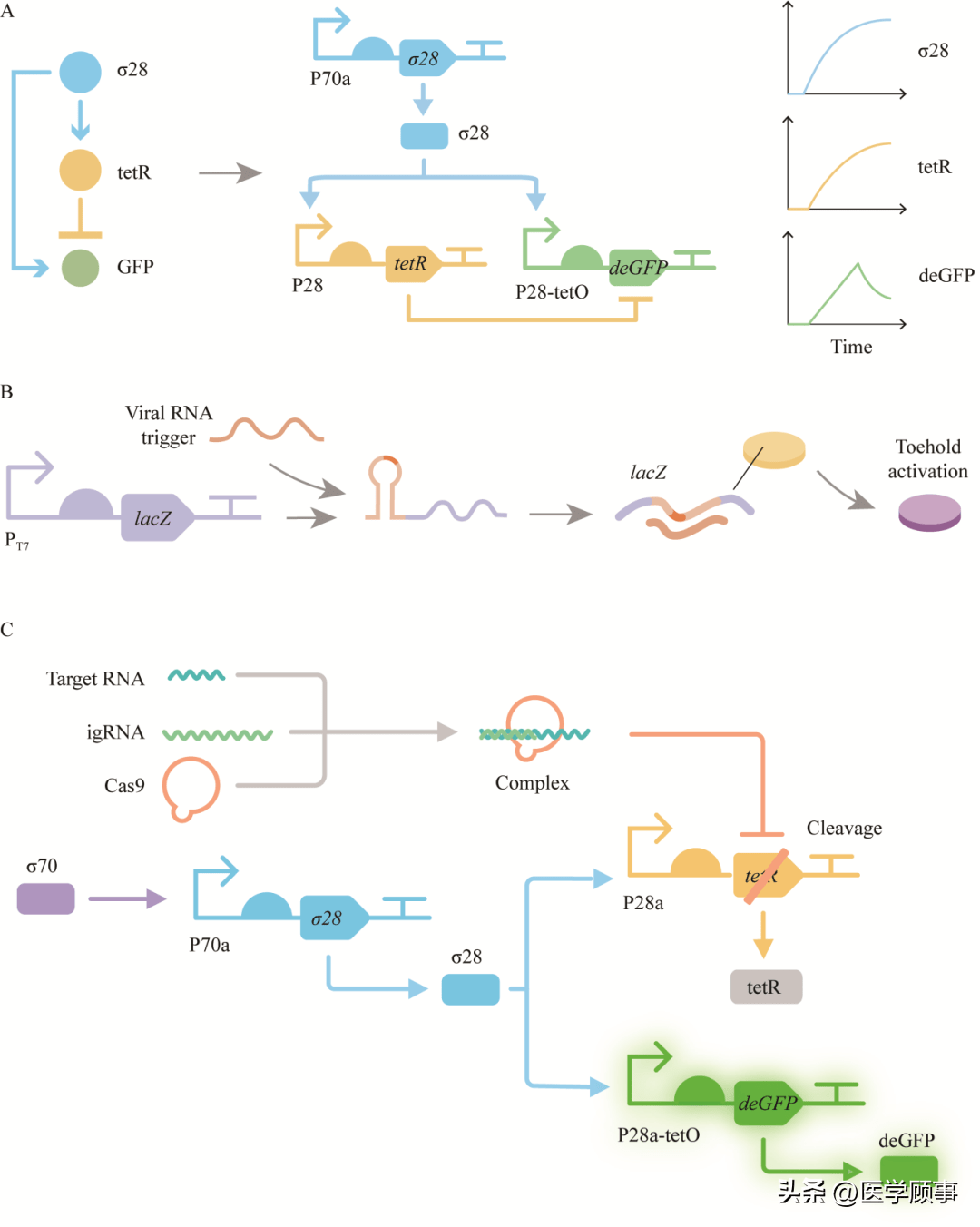
图7材料在无细胞传感器中的应用[22,36] IFFL存在于自然系统中,具有产生基因表达脉冲的能力,是一种被广泛研究的电路设计[57]。简单而言,IFFL电路通过第一条途径激活一个基因(tetR)和另一个基因(deGFP)的表达,而tetR的表达会抑制deGFP的表达。如果deGFP在被激活和被抑制的时间上有一个延迟,那么就可以看到该基因的表达脉冲[58](图8A)。2015年,康奈尔大学的Lucks课题组率先实现了IFFL电路在TXTL中的表达调控[59],通过测试得到了IFFL电路中3个原件的最佳浓度,避免了过量的DNA使TXTL表达量饱和。在deGFP蛋白的C端加入ssrA降解标签,能够被ClpXP蛋白降解,产生小脉冲。2021年,课题组联合浙江工业大学国际基因工程机器大赛(international genetically engineered machine competition, IGEM)竞赛团队ZJUT_China,构建了基于RNA响应的CRISPR/Cas9系统,目标RNA与gRNA碱基互补配对形成RNA-gRNA复合体,结合并引导Cas9蛋白切割IFFL线路中的tetR基因,导致下游deGFP基因的表达,通过荧光强度反正目标RNA的含量,获得了CRISPR/Cas系统的RNA生物传感器[60]。 如前文提到的,gRNA的编程化设计极大地拓展了对CRISPR/Cas系统的时序性调控,在gRNA/crRNA前的3′或5′端添加序列后,可将其变成RNA/DNA响应的核酸开关,如对CRISPR/Cas9系统中gRNA的设计改造而提出的msgRNA[28],igRNA[26]序列可用于构建更为复杂的基因电路;对CRISPR/Cas12a系统中的crRNA设计改造而用以检测细胞内源性RNA的传感器[27]。 3 存在的问题与展望 TXTL是推动基于CRISPR/Cas系统传感器开发的有利平台。传统的CRISPR生物传感器在构建过程中需要进行大量实验,来获得合适的PAM位点和高特异性的gRNA,而利用TXTL作为反应平台,能在短时间内实现蛋白表达,这一特性使对CRISPR系统中不同元件的表征与优化时间大大缩短,提高了实验效率。TXTL在CRISPR传感器方面的应用相比于传统的核酸扩增与诊断技术有较多优势,可将样品处理到信号检测等过程模块集成,冻干附于生物材料中,仅加入水即可激活,便于运输和携带,无需离心机、酶标仪等仪器,无需专业操作;灵敏度较高,可以实现微量病毒检测;结果读取方便,荧光信号可视化;能与更多的学科结合,发展潜力较大。 尤其,TXTL最大的优势在于能够在资源有限的国家和农村地区提供快速便捷的检测。传统的核酸检测技术需要解决的一个重要问题是温度——许多诊断试剂需要全程冷链运输及冷藏以维持蛋白或其余成分的活性,这对实际的现场应用造成了很大的障碍。而Collins课题组报道的冻干无细胞生物传感器实现了常温的运输和保存,并且可以稳定3个月及以上[22]。
图8工程化基因电路在TXTL中的应用[22,58,60]返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |