元素化学(格林伍德)笔记 第六章 硼 |
您所在的位置:网站首页 › ig是什么化学元素 › 元素化学(格林伍德)笔记 第六章 硼 |
元素化学(格林伍德)笔记 第六章 硼
|
§6.1导论 硼是周期表第ⅢA族唯一的非金属元素,像碳和硅一样,表现出明显的形成共价分子化合物的倾向。 在古代,人们就已知道硼砂,它用于制备釉和硬质玻璃。B的熔点很高,而且在高温时能迅速地与氮、氧及大多数金属反应。 硼几乎总是以硼酸盐矿或硼硅酸盐矿存在,具有商业价值的矿床很少。 §6.2硼元素一、硼的分离和提纯从硼的化合物中制备单质硼的主要方法有四种: (1)高温下用金属还原 栗子: B_{2}O_{3}+3Mg\rightarrow 2B+3MgO 强烈放热反应,由此制备的硼是“Moissan硼”,纯度为95-98%。也可以用其它电正性金属来还原(锂、钠、钾、铍、钙、铝、铁),但产品硼通常是无定形的,而且混杂有难熔的杂质(金属硼化物等)。大量的晶形硼是由三氯化硼和锌在一个900℃的流动系统中反应制得的。 (2)电解还原熔融的硼酸盐或四氟硼酸盐 如在800℃下在熔融的KCl/KF中电解还原 KBF_{4} 。这种方法相对便宜,但也只能得到纯度为95%的粉末状硼。 (3)用氢还原挥发性的硼化合物 在热的钽金属细丝上用氢气还原三溴化硼。 (4)热分解硼烷及卤化硼 在温度高达900℃时,硼烷热分解成无定形硼,而三碘化硼的热分解可得到晶形硼。 二、晶体硼的结构 确定单质硼的准确物理性质有两个困难,即硼的复杂多晶现象及其混杂有不能除去的杂质。硼是一种熔点高、密度低及电导率很低的极硬的难熔固体。晶体硼在透光时呈暗红色,而粉状硼则为黑色。 四、硼的化学性质B对O有很大的亲和力,这构成了硼酸盐及相应氧合配合物很普遍的化学基础。砌酸盐及相应氧合配合物很普遍的化学基础。最后,小体积的硼原子使许多间充式的合金型金属硼化物得以制成。硼原子能形成直链、支链或平面网络结构,还倾向于能形成具有巨大内在稳定性的三维排列结构,这种三维排列结构的框架可以按不同化学计量比间充金属原子。所有这些,使得合金型金属硼化物的范围得到明显的扩展。 B本身的化学活性明显取决于其纯度、结晶度、细分状态和温度。B在室温下就可以与氟气反应,其表面能与氧气作用,但与其他的物质无反应。在高温时硼几乎与所有的金属和非金属都容易直接作用。 在较低的温度下,B一般是化学惰性的。可以由如下事实证明:B能抗御沸腾的NaOH浓溶液或温度高达500℃的熔融NaOH的作用。不过B能被900℃熔融的碳酸钠/硝酸钠混合物溶解。分析单质硼时,用2:1热的浓硫酸/硝酸混合物溶解单质硼也很有效,然而非氧化性酸不与硼反应。 §6.3硼化物一、引言硼化物是一组具有200种以上的二元化合物,可以说基本上是只有你想不到,没有硼化物凑不出的化学计量比了。 富含金属的硼化物是极硬的、化学惰性的、不挥发的、熔点及电导率常常超过原来金属的难熔物质。硼化物常常制成粉末,但是可以通过粉末冶金及陶瓷工艺通用技术将其制成所需的形状。 TiB_{2}、ZrB_{2}、CrB_{2} 用于制作涡轮机叶片、燃烧室内衬、火箭喷嘴及烧蚀防护罩。硼化物或涂有硼化物的金属具有抵抗各种熔融金属、炉渣及盐的腐蚀能力,这使得它们可用于制作高温反应器、蒸发皿、坩埚、水泵转子及热电偶外壳。高温下对化学腐蚀的情性和极好的导电性预示着它们在工业生产中可用作电极。、 硼化物的核应用在于 ^{10}B 对热中子具有很高的有效吸收截面,即使是对于高能中子,它也有比其他任何核素都更高的有效吸收界面。因此,自核动力工业出现以来,金属硼化物和碳硼烷就一直广泛地用于中子屏蔽罩和控制棒。 硼碳化物在非核工业上的主要用途是作抛光或研磨用的磨料颗粒或磨料粉末;还用在制动器及离合器的摩擦片衬.上。此外,在制作轻质防护器具方面也很有用。试验已经表明,硼的碳化物及铍的硼化物最好用在防弹服及飞船防护板中。更妙的是,现在能通过三卤化硼/氢气与碳丝在1600~1900℃下反应制成纤维状的硼碳化物: 4BCl_{3}+6H_{2}+C\rightarrow B_{4}C+12HCl 二、硼化物的制备及其化学计量学合成硼化物的一般可行方法有8种,前四种使用于小规模的实验室制备,后四种适合于规模从公斤级到吨级的商业生产。由于涉及到高温且产物不挥发,故硼化物不容易制得很纯,随后的提纯也常常十分困难;有时精确的化学计量也难以实现,原因在于硼化物挥发性很小或者活化能很高。硼化物的制备方法是: (1)单质直接化合:这种方法可以得到最广泛的应用。 栗子: Cr+nB\rightarrow CrB_{n} 条件:1150℃ (2)用硼还原金属氧化物(会造成贵重元素、硼的浪费) 栗子: Sc_{2}O_{3}+7B\rightarrow 2ScB_{2}+3BO 条件:1800℃ (3)利用金属细丝、热管或等离子枪,用氢还原挥发性的卤化物混合物 栗子: 2TiCl_{4}+4BCl_{3}+10H_{2}\rightarrow 2TiB_{2}+20HCl (4)用金属(或氢气)还原三氯化硼(或其他三卤化硼) 栗子:  (5)由熔融盐的电解沉积:这种方法对制备MBx(M-碱土金属或稀土金属)及Mo, W, Fe, Co, Ni的硼化物特别有效。 将金属氧化物及三氧化二硼(或硼砂)溶解在一-种合适的熔融盐浴里,并在700~ 1000℃利用石墨阳极电解,硼化物便沉积在石墨或钢制的阴极上。 (6)在温度高达2000℃时,用碳还原氧化物的混合物 栗子: V_{2}O_{5}+B_{2}O_{3}+8C\rightarrow 2VB+8CO (7)用硼碳化物还原金属氧化物(或金属和三氧化二硼)   硼碳化物是硼的最有用和最经济的来源,并能与大多数金属或其氧化物反应。硼碳化物以吨量级地用碳在1600℃ 下直接还原三氧化二硼生产,方法是将一个碳电阻器埋放在三氧化二硼和碳的混合物中,同时通以很强的电流。 (8)用金属(Mg或Al)与混合氧化物发生铝热剂型的还原反应,这样通常得到的是掺杂了三元硼化物(如 Mo-Al_{6}B_{7} ) 的产物。此外,还原剂也可以用碱金属或钙。 栗子: TiO_{2}+B_{2}O_{3}\rightarrow TiB_{2} 三、硼化物的结构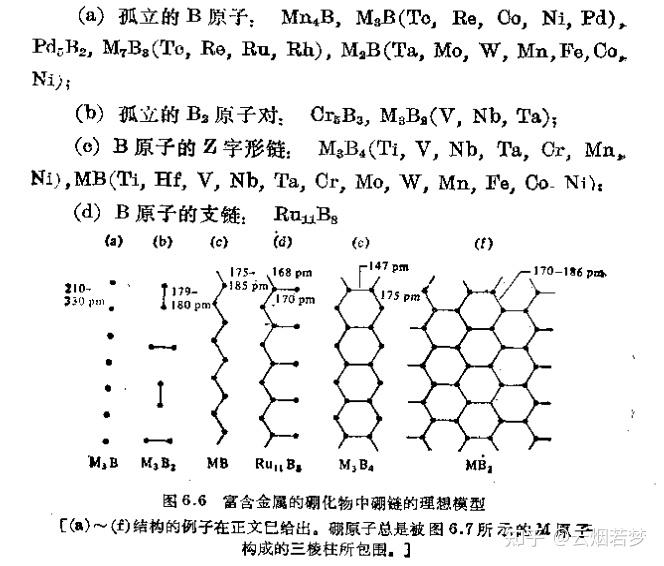  §6.4硼烷 §6.4硼烷结构啥的就不多介绍了w 一、硼烷的性质硼烷是无色的、抗磁性的、热稳性中等到低等的分子化合物。低级硼烷在室温下为气体,但随着分子量增加,它们变成挥发性的液体或固体;沸点接近于分子量相近的碳氢化物。硼烷的生成都是吸热的,其生成吉布斯自由能也为正值,其热力学不稳定性起因于单质硼和单质氢气中原子间的键特别强,并不是B-H键原本就弱(在这一点上,硼烷类似于碳氢化物)。  硼烷极其活泼,有几种硼烷能在空气中自燃。蛛网形硼烷比巢形硼烷更趋活泼(且对热分解更不稳定),同时反应活性还随分子量的增加而减小。笼形硼烷阴离子特别稳定,其一般的化学性质已经使人联想到“三维芳香性”[1]这个术语。 二、乙硼烷的化学乙硼烷占有特殊的地位,因为别的硼烷全都是由它制备的(直接或间接)。在整个化学中,乙硼烷也是研究最多以及在合成上最有用的试剂之一。少量的乙硼烷气体可以用如下方法制备:  当我们不需要对制得的乙硼烷进行分离和提纯时(比如说,只是为了原位制备来参与反应),最好的方法是下面这个:  一个类似麦尔外因盐的物种,可以参与原位制备乙硼烷w 一个类似麦尔外因盐的物种,可以参与原位制备乙硼烷w就工业生产,我们可以在180℃下直接用 NaH 还原 BF_{3} 气体来生产:  产品应及时分离以防止接着发生热分解 产品应及时分离以防止接着发生热分解乙硼烷可以自燃,所以上面的这些制备方法操作时都要小心谨慎。 乙硼烷的热分解十分复杂,其起始步骤是单分子的分解平衡还是双分子歧化反应尚没有统一的看法。  (括号{ }里的是瞬时存在的不稳定的反应中间物) (括号{ }里的是瞬时存在的不稳定的反应中间物)乙硼烷的桥键很容易断开,甚至通过很弱的配位体就可以得到对称的或不对称的裂解产物:  控制这些反应过程的因素尚未完全清楚,但空间效应肯定起某种作用,如用 NH_{3}、MeNH_{2} 、Me_{2}NH 得到的是不对称裂解的产物,而用 Me_{3}N 得到的是对称裂解的产物 Me_{3}NBH_{3} 。对称裂解是更普遍的模式,而且热化学及光谱学的资料表明, LBH_{3} 的加合稳定性有如下次序:  硫化物加合物的相对稳定性较大,而且还知道许多含有N,P,O,S等电子给予体原子的其它配合物。配位体 H^{-} 是个特殊情况,因为它得到的是对称的四面体形离子 BH_{4}^{-} (与 CH_{4} 是等电子体)。 BH_{4}^{-} 离子本身是一种少有的单齿、双齿或三齿配体。  关于四氢硼酸盐可以看下面这篇文章: 除了热分解和裂解反应外,乙硼烷还发生种类繁多的取代、再分配及溶剂化反应,其中代表性的反应如下: 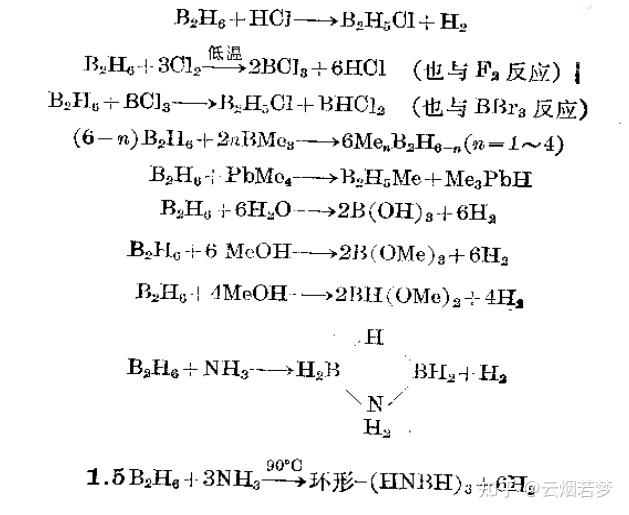  乙硼烷与金属(如Na,K,Ca)或其混合物反应缓慢(反应时间在几天以上),醚存在时反应比较迅速:  用这种方法制备的 B_{3}H_{8}^{-} 是首次得到的多硼烷阴离子(1955年),现在可以由下列反应较方便地制取:  参考^https://www.docin.com/p-1631821522.html 参考^https://www.docin.com/p-1631821522.html
|
【本文地址】