基于单细胞测序和转录组分析的胰腺癌坏死相关预后模型 |
您所在的位置:网站首页 › icgc数据库 › 基于单细胞测序和转录组分析的胰腺癌坏死相关预后模型 |
基于单细胞测序和转录组分析的胰腺癌坏死相关预后模型
|
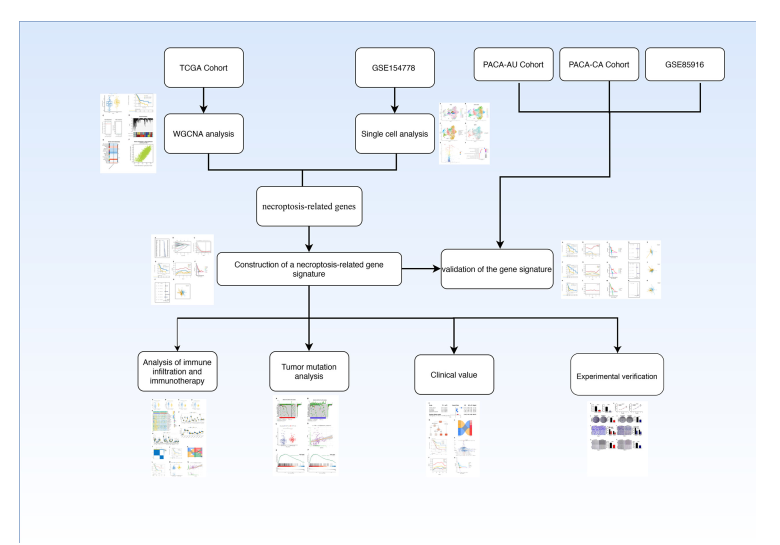
胰腺癌作为一种死亡率高、疗效差的肿瘤类型,其发病机制尚不清楚。目前有作者通过TCGA数据库、ICGC数据库和GEO数据库(GSE85916),利用单细胞测序分析和转录组分析构建了胰腺癌坏死性凋亡相关的标记,构建胰腺癌预后模型,为胰腺癌的诊断、治疗及预后评估提供参考。该研究发表在《Frontiers in Immunology》,IF:8.786。
实验方法: 将TCGA队列设置为训练队列,将ICGC和GSE85916队列设置为验证队列。胰腺癌单细胞测序数据来自GEO数据库中的GSE154778。通过加权共表达网络分析和单细胞测序分析,确定了与坏死最相关的基因。对这些基因进行COX回归和Lasso回归,建立预后模型。通过计算风险评分,将胰腺癌患者分为NCPTS_high组和NCPTS_low组,进行组间生存分析、免疫浸润分析和突变分析。通过基因敲除、CCK-8实验、克隆形成实验、transwell实验和创面愈合实验等细胞实验,探讨关键基因EPS8在胰腺癌中的作用。对临床样本进行PCR检测,验证EPS8的表达。
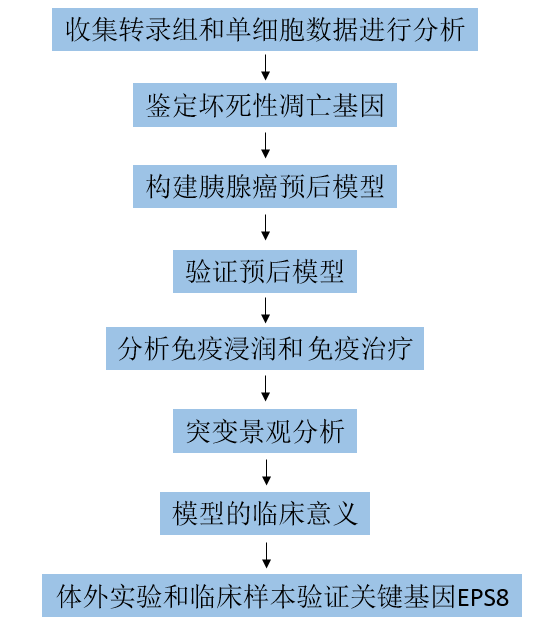
技术路线:
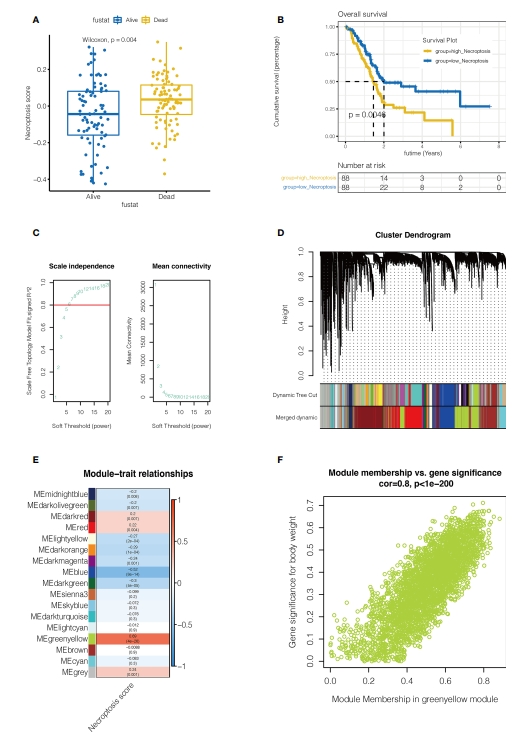
主要研究结果: 1. 加权基因共表达网络分析 该研究的流程图如图1所示。如图2A, B所示,采用ssGSEA对每个样本进行坏死性凋亡(necroptosis)评分。根据坏死评分中位数将患者分为高坏死组和低坏死组,较高的坏死评分胰腺癌患者死亡率很高。此外,高坏死组患者预后较差(P 0.8时,数据更符合幂律分布,平均连通性趋于稳定,适合后续分析。如图2D所示,共得到27个非灰色模块。然后,将模块的相似度域值设置为0.4,对低于该值的模块进行合并,最终得到16个非灰度模块。作者发现,MEgreenyellow模块与坏死性凋亡密切相关,包含3352个基因(COR = 0.8, P
图1实验流程图
图2单样本基因集富集分析(ssGSEA)和加权基因共表达网络分析(WGCNA)
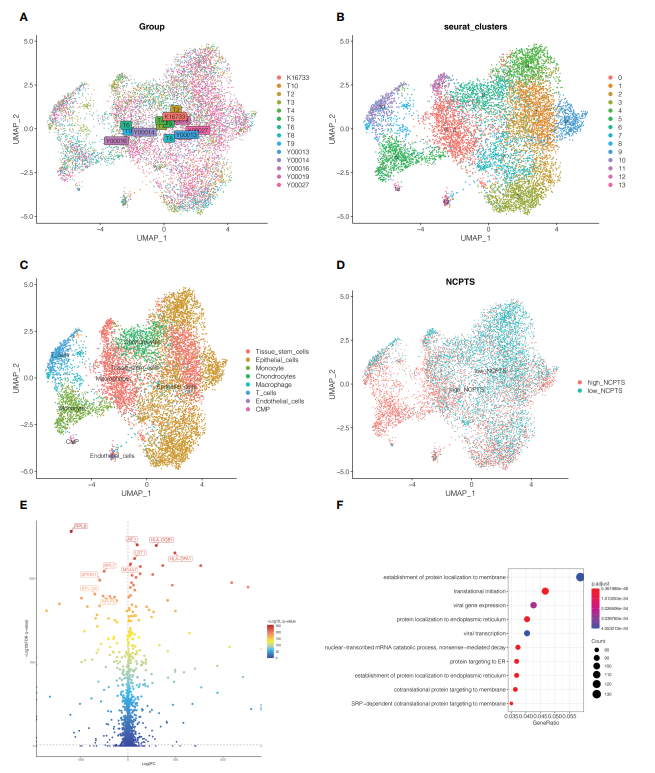
2. 单细胞测序分析 如图3A所示,研究共纳入14个样本,各样本间细胞分布较为均匀,说明样本间不存在明显的批量效应,可用于后续分析。随后,所有细胞聚类为14个簇(图3B),分为8种细胞类型(图3C),如上皮细胞、巨噬细胞和T细胞。根据每个细胞中坏死基因的特点,确定每个细胞中坏死基因的百分比。根据中位数将细胞分为高、低两组,即高NCPTS组和低NCPTS组(图3D)。经P
图3单细胞测序分析
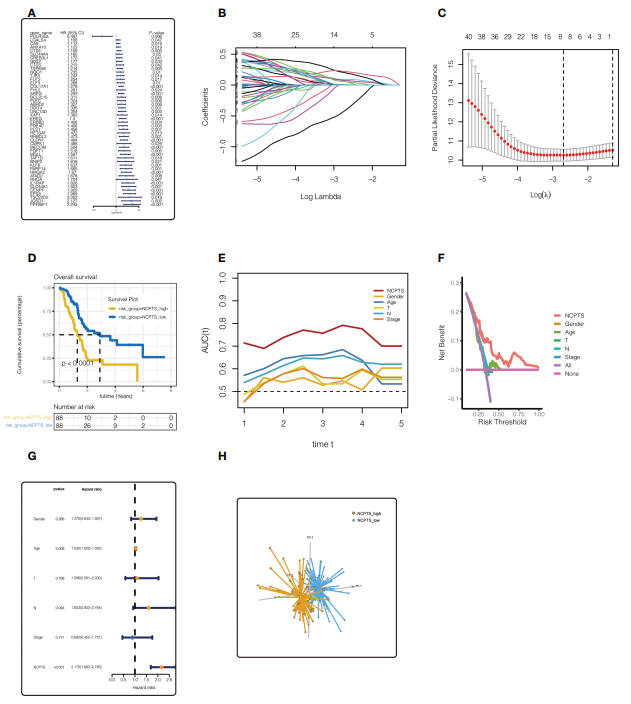
3. TCGA队列中预后模型的构建与评价 为了进一步鉴定与预后相关的坏死基因,对TCGA和PA-AU组805个坏死基因进行单因素Cox分析,鉴定出48个坏死基因,(p
图4 TCGA队列预后模型的建立
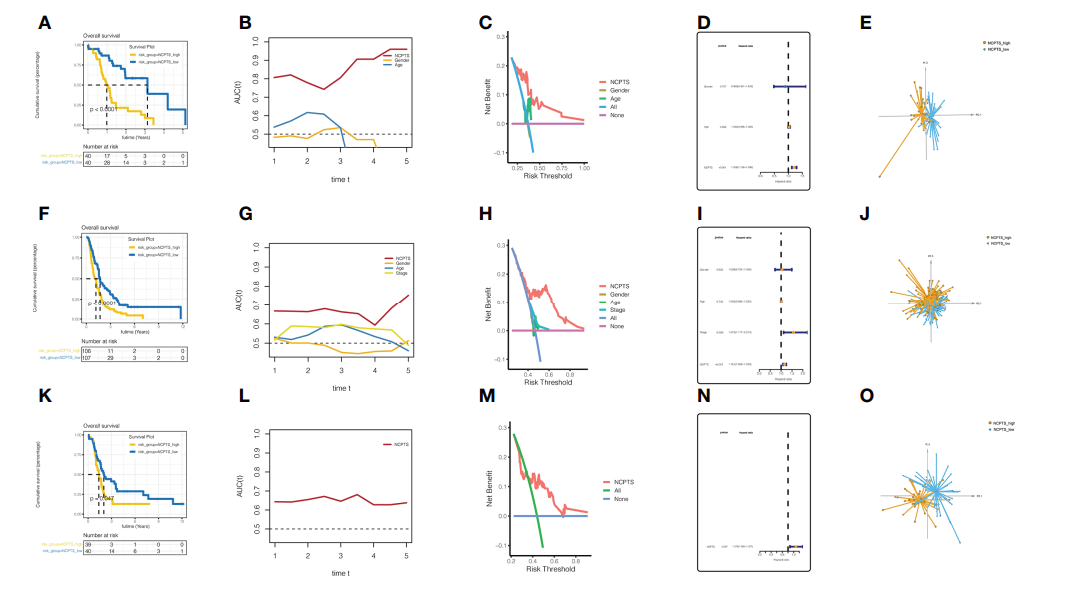
4. 预后模型的外部验证和评估 在外部验证队列PA-AU(图5A-E)、PA-CA(图5F-J)和GSE85916(图5K-O)中也观察到了类似的结果。在PA-AU队列(图5A-E)和PA-CA队列(图5F-J)中,NCPTS_high组患者的预后较NCPTS_low组患者差。此外,预后ROC分析显示,曲线下AUC波动在0.85 ~ 0.7之间,对患者的预后评估有较好的效果,优于性别、年龄等临床特征(图5B, G)。决策曲线分析也显示,以NCPTS为干预依据的患者获益最大(图5C, H)。多因素Cox分析显示,NCPTS是影响患者预后的独立因素(图5D, I),并且该模型能够很好地将患者区分为NCPTS_high和NCPTS_low组(图5E, J)。同样,在GSE85916队列中,发现NCPTS_high患者的预后较差,通过预后ROC分析发现曲线下AUC较为稳定,波动为0.65(图5K, L)。通过决策曲线分析也表明基于NCPTS的临床干预具有合理的效益效果(图5M)。单因素Cox分析显示,NCPTS是一个预后因素(图5N)。此外,该模型仍然可以将患者区分为NCPTS_high和NCPTS_low组(图5O)。
图5预测模型的外部验证和评估
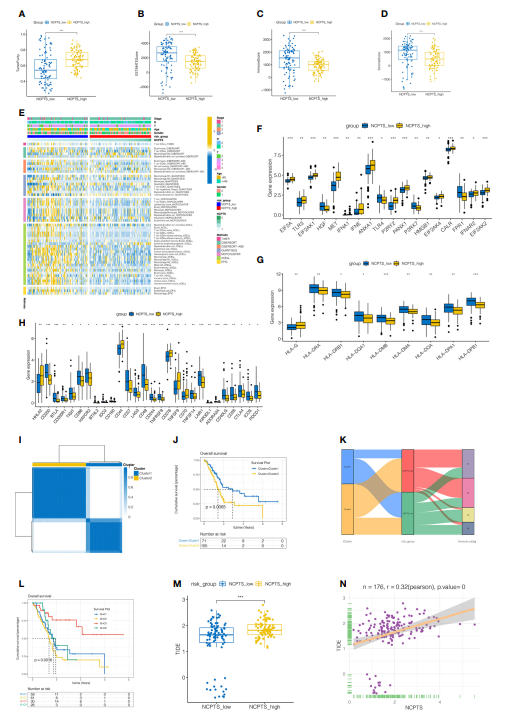
5. 免疫浸润分析和识别更适合免疫治疗的患者 免疫微环境在患者预后中起着重要作用。分析NCPTS_low组和NCPTS_high组的免疫浸润情况。如图6A-D所示,与NCPTS_high组相比,NCPTS_low组的估计评分、免疫评分和间质评分较高(P
图6 TCGA队列中更适合免疫治疗的患者免疫浸润分析及鉴别
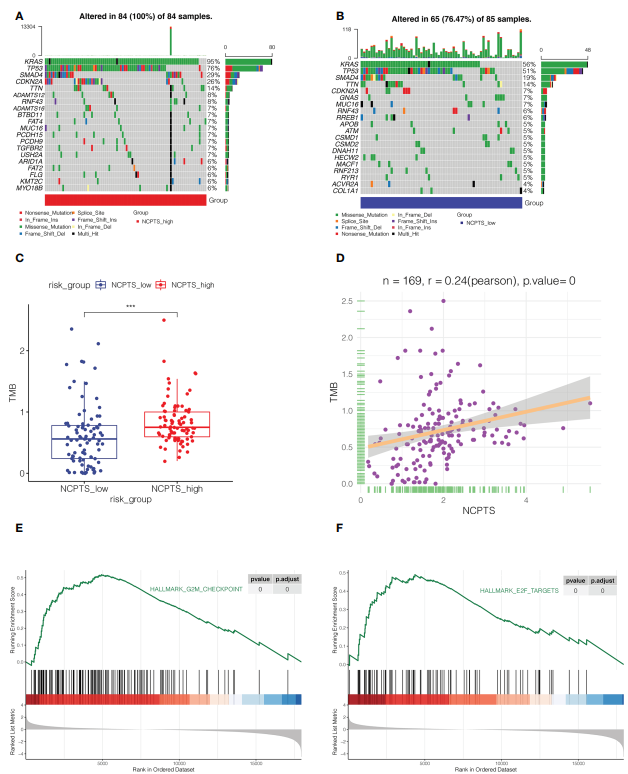
6. 突变景观分析 基因突变在肿瘤发生发展和患者预后中也起着重要作用。在NCPTS_high组和NCPTS_low组中,突变频率最高的5个基因分别是KRAS、TP53、SMAD4、CDKN2A和TTN(图7A,B)。NCPTS_high组TMB较高,且TMB与NCPTS呈正相关(P
图7突变景观分析
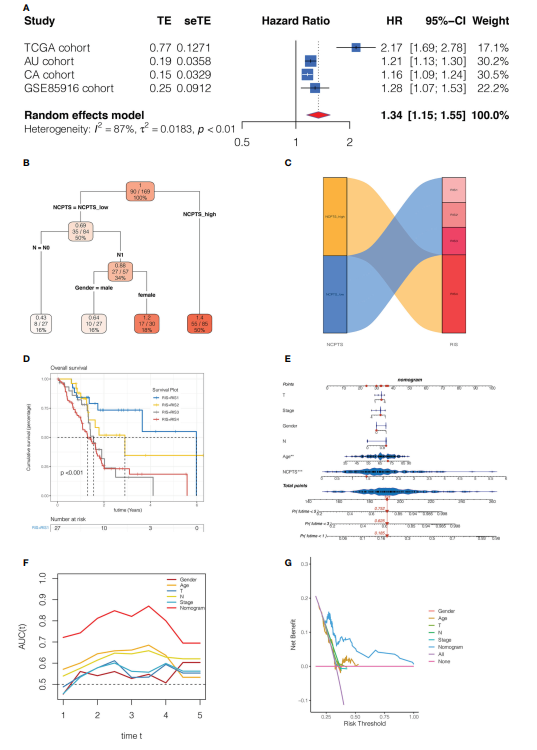
7. 模型的临床意义 对不同队列NCPTS的预后影响进行了荟萃分析。在图8A中,发现合并的HR值表明NCPTS仍然是患者预后不良的一个促成因素。为了进一步促进临床胰腺癌患者风险组的分类和管理,对NCPTS和临床特征进行了决策树分析。根据NCPTS水平、性别、N期可将患者分为4个危险组:RIS1、RIS2、RIS3、RIS4(图8B)。RIS4患者均分布在NCPTS_high组,而RIS1、RIS2、RIS3患者分布在NCPTS_low组(图8C)。生存分析发现,RIS4组预后不良(P
图8模型的临床意义
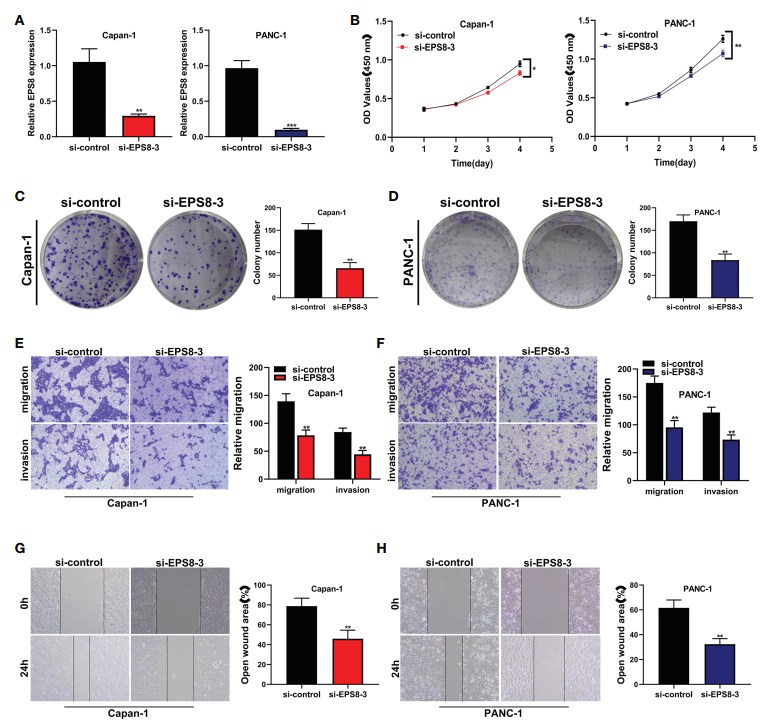
8. 体外验证关键基因EPS8在胰腺癌细胞株中的作用 在CAPAN-1和PANC-1细胞系中,EPS8显著减少(图9A)。在CAPAN-1和PANC-1细胞系中,EPS8敲除后胰腺癌细胞的活性显著降低(图9B)。随后,克隆形成试验显示,EPS8敲除后,CAPAN-1细胞系(图9C)和PANC-1细胞系(图9D)产生菌落的能力大大降低。在transwell实验中,EPS8的敲除显著降低了CAPAN-1细胞系和PANC-1细胞系中胰腺癌细胞的迁移和侵袭能力(图9E, F)。创面愈合实验中,si-EPS8组EPS8在CAPAN-1细胞和PANC-1细胞中的迁移能力较弱(图9G, H)。
图9体外验证了关键基因EPS8在胰腺癌细胞系中的作用
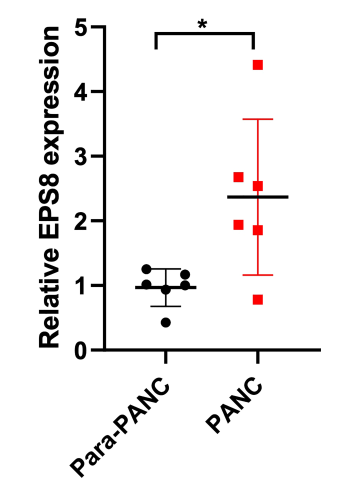
9. 通过对临床标本进行PCR检测,验证EPS8在胰腺癌组织中的表达 为了进一步验证EPS8在临床标本中的表达,进行PCR检测。结果发现,与癌旁组织相比,胰腺癌组织中EPS8表达明显上调(图10)。
图10 EPS8表达的临床验证
结论: 通过结合单细胞测序和转录组分析的结果,作者构建了胰腺癌的坏死性凋亡相关预后特征,该的预测特征可以有效评估胰腺癌患者的预后,在一定程度上为胰腺癌的治疗提供参考。
|
【本文地址】
今日新闻 |
推荐新闻 |