人乳头状瘤病毒核酸检测用于宫颈癌筛查中国专家共识(2022)解读 |
您所在的位置:网站首页 › hpv检测两个阳性,是什么原因引起的 › 人乳头状瘤病毒核酸检测用于宫颈癌筛查中国专家共识(2022)解读 |
人乳头状瘤病毒核酸检测用于宫颈癌筛查中国专家共识(2022)解读
|
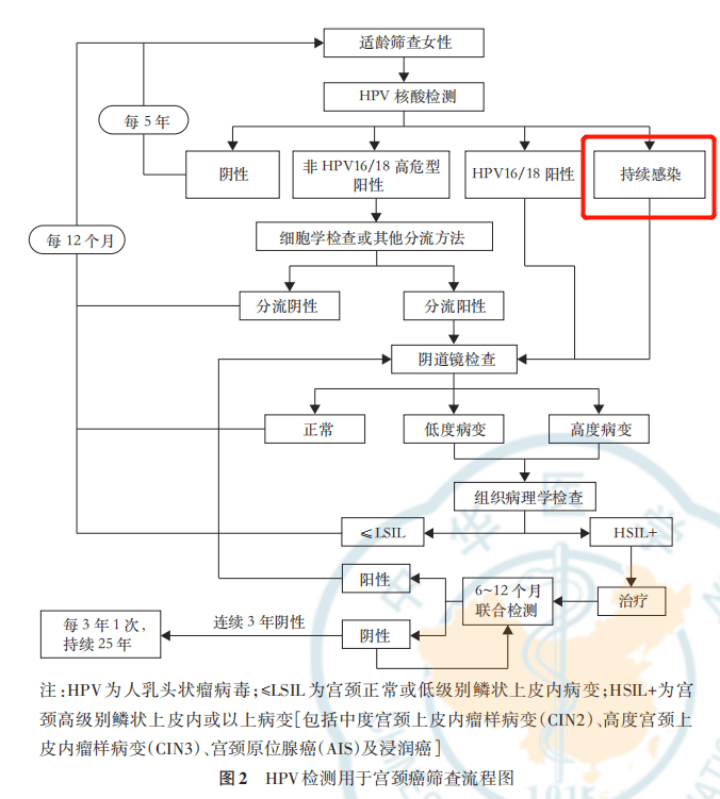
推荐意见2 HPV核酸检测方法可以分为非扩增法和扩增法,这些方法可对HPV全基因组或某一片段(例如:以L1 DNA、E6/E7 DNA或mRNA等为检测靶点)进行有效检测。 3 HPV筛查流程 对适龄女性采用HPV核酸检测进行初筛,阴性者间隔5年后再次进行检测。对HPV初筛阳性者采用HPV基因分型和细胞学检测联合分流方法:HPV16/18阳性者及HPV持续感染者直接转诊阴道镜,非HPV16/18阳性者采用细胞学检测进一步分流。细胞学阴性者12个月后再次进行HPV核酸检测,细胞学阳性者直接转诊阴道镜。对阴道镜检查结果为低度及以上病变者行病理检查,病理结果为宫颈正常或低级别鳞状上皮内病变者(≤LSIL)12个月后再次进行HPV核酸检测,病理结果为HSIL+者进行治疗,并在6~12个月后采用HPV核酸及细胞学联合检测进行随访,结果阳性者转诊阴道镜,阴性者每年进行1次随访,连续3年阴性则转为每3年1次随访,持续25年。流程见图2。 根据文献研究和临床经验, HPV持续感染可定义为:间隔 6~12个月的相邻 2次检测中,同一个体的宫颈检测样品显示为同种型别 HPV阳性 [8-11] 。
推荐意见3 (1)筛查人群:①优先对35-64岁女性进行筛查;②条件允许可纳入常规体检;单位组织的体检中也建议遵循这一建议。 (2)筛查方法:推荐将HR-HPV检测作为人群宫颈癌筛查的首选方法,筛查间隔为5年。 (3)HPV检测方法的选择:①至少检测13种HR-HPV(HPV16、18、31、33、35、39、45、51、52、56、58、59、68);②有条件时建议至少进行HPV16/18分型检测;③采用NMPA批准且通过实验室分析性能验证和临床性能验证的HPV检测方法。 (4)对于筛查中检出的HPV阳性者,应根据其发生HSIL+风险确定进一步管理建议:①HPV16/18阳性者直接转诊阴道镜检查;②非HPV16/18阳性者建议进行分流检测(细胞学检查或其他方法),分流检测阳性者转诊阴道镜检查; ③HR-HPV持续感染者建议直接转诊阴道镜检查。 展望 (1)HPV核酸检测创新技术发展 一方面需要开发更加 自动化、智能化、标准化的核酸检测一体机,更好地满足宫颈癌国家筛查计划对于大批量样品检测的需求;另一方面需要开发操作 更便捷、更低成本、更省时的便携式、小型化即时检测(POCT)系统,满足对结果的及时性需求。探索将 HPV自采样方法应用于筛查实践的实施策略,以保障包括医疗资源相对不足地区在内的女性宫颈癌筛查的可及性。鼓励开展宫颈癌防控服务模式的实践应用与真实世界研究,应用模型预测宫颈癌防治效果和成本效益,为优化宫颈癌防控策略提供证据。 (2)HPV核酸检测的信息化管理 推动大数据、互联网等新一代信息技术与HPV核酸检测和宫颈癌筛查服务深度融合,推进 电子病历、智慧服务、智慧管理的信息标准化建设。 (3)HPV核酸检测在HPV疫苗接种后时代的应用 随着HPV疫苗接种的普及,我国将逐步进入后HPV疫苗时代,HPV疫苗覆盖型别感染及相关HSIL+发生率将下降,但是归因于非疫苗保护型别的宫颈病变问题将会日渐凸显,因此探索适合该阶段的基于HPV核酸检测的筛查策略成为亟待解决的问题。 (4)HPV核酸检测在其他HPV相关疾病防控中的应用 除宫颈病变外,HR-HPV感染还与 肛门、阴茎、头颈等部位的癌前病变和浸润性癌相关,LR-HPV感染可引起肛门-生殖器疣和复发性呼吸道乳头状瘤等疾病。HPV检测对于以上非宫颈部位的HPV相关疾病防控也具有重要意义。 圣湘生物的产品理念及发展规划高度契合《共识》指导意见,基于快速核酸释放技术、磁珠法核酸提取技术开发的一系列精准、高效、可及的荧光PCR法HPV检测产品,信息系统与全场景实验室解决方案,可积极助力加速消除宫颈癌战略下的筛查质量及效率提升。
参考文献 [2] LiM, LiuT, LuoG, et al. Incidence, persistence and clearance of cervical human papillomavirus among women in Guangdong, China 2007-2018: a retrospective cohort study[J]. J Infect Public Health, 2021, 14(1):42-49. DOI: 10.1016/j.jiph.2020.11.011. [3] BondeJ, BottariF, IacoboneAD, et al. Human Papillomavirus Same Genotype Persistence and Risk: a Systematic Review[J]. J Low Genit Tract Dis, 2021, 25(1):27-37. DOI: 10.1097/LGT.0000000000000573. [4] BondeJH, SandriMT, GaryDS, et al. Clinical Utility of Human Papillomavirus Genotyping in Cervical Cancer Screening: a Systematic Review[J]. J Low Genit Tract Dis, 2020, 24(1):1-13. DOI: 10.1097/LGT.0000000000000494. [5] 田亚宾, 张春涛. 人乳头状瘤病毒核酸分型检测试剂的研究进展[J]. 中华肿瘤杂志, 2018, 40(10):729-735. DOI: 10.3760/cma.j.issn.0253-3766.2018.10.003. [9] Koshiol J, Lindsay L, Pimenta JM, et al. Persistent human papillomavirus infection and cervical neoplasia: a systematic review and meta‑analysis[J]. Am J Epidemiol,2008, 168(2):123‑137. DOI: 10.1093/aje/kwn036. [10] Rositch AF, Koshiol J, Hudgens MG, et al. Patterns of persistent genital human papillomavirus infection among women worldwide: a literature review and meta‑analysis[J]. Int J Cancer, 2013, 133(6):1271‑1285. DOI: 10.1002/ijc.27828. [11] Stanley M. Host defence and persistent human papillomavirus infection[J]. Curr Opin Virol, 2021, 51:106‑110. DOI: 10.1016/j.coviro.2021.09.010. 撰写 | 张赛 校稿 编审 | 刘娟 缪为民 编辑 | 谭易秋子 注:图片源于网络 侵删 点击加入基因俱乐部 成就行业精英 目前已有600+行业精英加入基因俱乐部 已发布各类基因科技行业报告2300多份返回搜狐,查看更多 |
【本文地址】