已知某温度下CH3COOH和NH3・H2O的电离常数相等.现向10mL浓度为0.1mo1・L |
您所在的位置:网站首页 › hcooh和ch3cooh酸性 › 已知某温度下CH3COOH和NH3・H2O的电离常数相等.现向10mL浓度为0.1mo1・L |
已知某温度下CH3COOH和NH3・H2O的电离常数相等.现向10mL浓度为0.1mo1・L
|
【知识点】酸碱混合时溶液定性判断H1 H2 H6 【答案解析】D 解析:A、向10mL浓度为0.1mo1・L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中水的电离程度先增大,随着氨水浓度的增加水的电离被抑制,水的电离程度减小,故A错误;B、当向CH3COOH溶液中滴加相同浓度的氨水,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh= 故答案选D 【思路点拨】本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,注意电荷守恒以及电离常数不随温度变化的灵活应用。
|
【本文地址】
今日新闻 |
推荐新闻 |
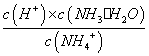 ,随着氨水的加入,c(H+)逐渐减小,Kh不变,c(NH4+) / c (NH3・H2O)变小,当加氨水至溶液显碱性时,氨水的电离常数
,随着氨水的加入,c(H+)逐渐减小,Kh不变,c(NH4+) / c (NH3・H2O)变小,当加氨水至溶液显碱性时,氨水的电离常数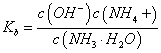 随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+) / c (NH3・H2O)变小,所以c(NH4+) / c (NH3・H2O)始终减小,故B错误;C.n(CH3COOH)与n(CH3COO-)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,故C错误; D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),故D正确;
随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+) / c (NH3・H2O)变小,所以c(NH4+) / c (NH3・H2O)始终减小,故B错误;C.n(CH3COOH)与n(CH3COO-)之和为0.001mol,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,故C错误; D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),故D正确;