ABclonal程序性细胞死亡系列(二)细胞自噬特征盘点及检测指南 |
您所在的位置:网站首页 › hacat细胞形态特征 › ABclonal程序性细胞死亡系列(二)细胞自噬特征盘点及检测指南 |
ABclonal程序性细胞死亡系列(二)细胞自噬特征盘点及检测指南
|
自噬特征 自噬是一种进化上保守的分解代谢途径,负责将受损的细胞器、错误折叠的蛋白及其他大分子物质等通过形成的双层膜包裹的囊泡—自噬体,运送至溶酶体降解并再利用[1-3]。在营养缺乏、能量代谢异常、缺血、缺氧、病原体感染的情况下自噬通常会被激活,此外与许多生理病理过程关联,如发育、分化、免疫、感染、炎症、肿瘤、心血管病、神经退行性疾病等[4]。自噬主要有三种途径:巨自噬(macroautophagy),微自噬(Microautophagy)和分子伴侣介导的自噬(Chaperone-mediated autophagy, 简称CMA)[5]。 自噬形态学特征 通过超微结构而鉴定的自噬的形态学特征表现在如下几个方面: 1) 高尔基体和内质网等细胞器膨胀 2) 胞质无定形,核碎断、固缩 3) 形成大量吞噬泡(由粗面内质网包围将要被吞噬的底物,随后与初级溶酶体结合形成) 4) 细胞质膜失去特化,可能发生细胞膜出泡现象
图1:自噬与正常细胞以及其他死亡形式细胞形态学比较。(a)正常细胞,(b)自噬细胞,(c)凋亡细胞,(d)坏死细胞
自噬其他特征 1) 细胞正常情况下很少发生自噬,除非有诱发因素的存在。这些诱发因素很多,也是研究的热门。既有来自于细胞外的(如外界中的营养成分、缺血缺氧、生长因子的浓度等),也有细胞内的(代谢压力、衰老或破损的细胞器、折叠错误或聚集的蛋白质等)。由于这些因素的经常性存在,因此,细胞保持了一种很低的、基础的自噬活性以维持自稳。 2) 自噬过程很快,被诱导后8min即可观察到自噬体(autophagosome)形成,2h后自噬溶酶体(autolysosome)基本降解消失。这有利于细胞快速适应恶劣环境。 3) 自噬的可诱导特性,表现在2个方面: 第一是自噬相关蛋白的快速合成,这是准备阶段。 第二是自噬体的快速大量形成,这是执行阶段。 4) 批量降解,这是与蛋白酶体降解途径的显著区别。 5) “捕获”胞浆成分的非特异性:由于自噬的速度要快、量要大,因此特异性不是首先考虑的,这与自噬的应急特性是相适应的。 6) 自噬的保守性:由于自噬有利于细胞的存活,因此无论是物种间、还是各细胞类型之间(包括肿瘤细胞),自噬都普遍被保留下来。
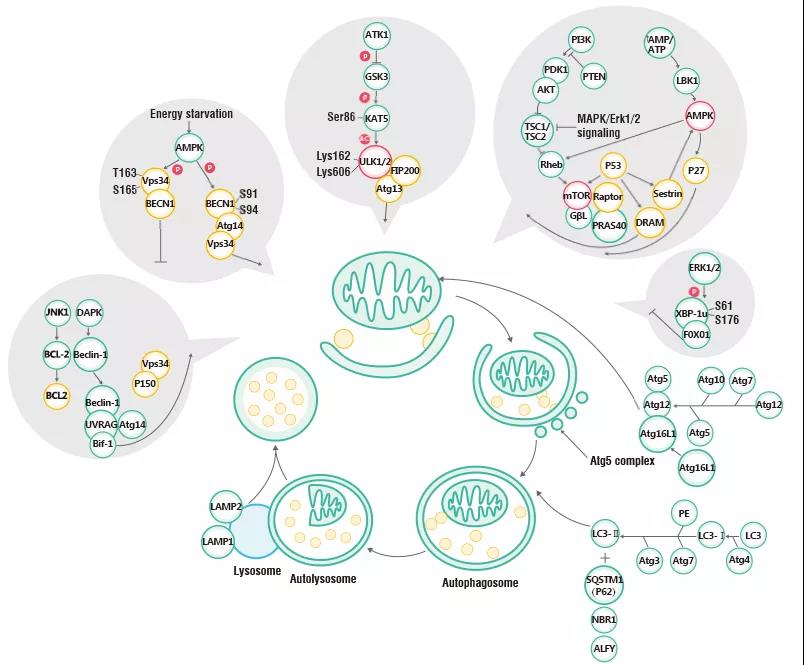
自噬通路概述 自噬的整个过程中, 时刻都受到不同的自噬相关基因(autophagy-related gene, ATG)的调控, 大约已有38个自噬相关基因被发现,这些基因在酵母和哺乳动物高度保守[2, 6]。典型的自噬(主要是巨自噬)过程如图3所示,是由ULK1激酶复合体(它由ULK1、ULK2、 ATG13、 FIP200和ATG101组成)起始,并接收来自mTOR复合体1(mTORC1)的应激信号。当mTORC1的激酶活性被抑制,自噬体形成过程开始发生[7, 8]。这涉及VPS34与AMBRA1、BIF-1和Bcl-2相互作用后,进而与Beclin 1形成一个复合体。VPS34的结合是至关重要的,因为其脂质激酶活性是自噬体形成所必需的[9]。目前的研究表明,ULK1对Beclin 1的磷酸化引发了含VPS34的ATG14L复合体的活性,促进了自噬的诱导[10]。自噬体形成也需要ATG12和LC3,以及类似于泛素连接酶系统的蛋白偶联系统。LC3系统对自噬体的运输和成熟是非常重要的[11],一旦自噬体已经成熟,它将与溶酶体外膜发生融合并降解其运输的内容物。
图2:自噬信号通路及关键参与蛋白 细胞自噬检测解决方案
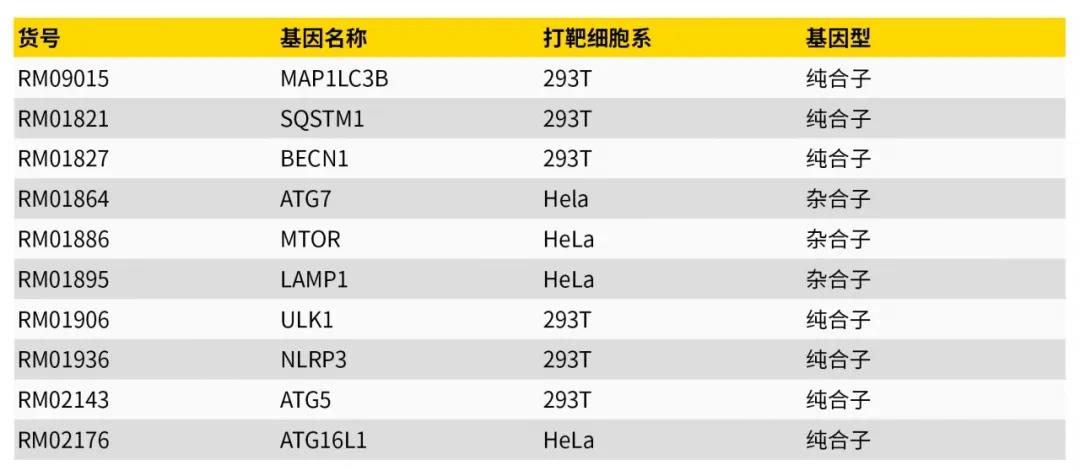
1.自噬检测常用KO细胞模型产品 细胞自噬过程中,经常会用到一些KO细胞模型,ABclonal为了方便大家进行机制研究,提供自噬核心靶点KO细胞模型产品(图4),同时ABclonal也可提供CRISPR/Cas9基因敲除服务。
图3:自噬核心靶点KO细胞模型(节选)
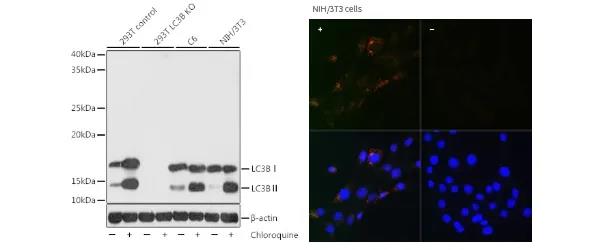
2.自噬检测常用方法 ➤方法一:文献最常用的自噬检测方法是蛋白印迹检测自噬标志物(Autophagy Marker)LC3的转换(LC3-II/LC3-I)以及荧光显微镜检测LC3点状聚集物的形成。 自噬形成时,胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为自噬体膜型(即LC3-II),因此,LC3-II/I比值的大小可估计自噬水平的高低。目前大部分LC3抗体选择的抗原位于N端,PE基团的加入可能会使得N端蛋白构象变化,导致抗体对LC3的亲和力增强,所以LC3-II条带深并不能代表该样本处于高自噬状态。另外,LC3-I对冻融比较敏感,容易在SDS上样缓冲液降解。所以在做半定量检测时,除了使用LC3-II/LC3-I的比值外,也可以配合使用LC3-II与管家蛋白的比值进行半定量。由于LC3是脂化和膜相关蛋白,在细胞裂解时,可在冰上短暂超声,以促进蛋白溶解,使得LC3顺利从膜上解离。此外LC3-I的分子量约16KD,LC3-II在电泳后停留在14KD处,LC3-I和LC3-II均为小分子量蛋白,且差距仅2KD,所以在WB时要注意使用高浓度分离胶进行分离(建议约15%),转膜时使用小孔径0.2μm的 NC膜,采用恒流200mA,转膜40min即可。 (Note:LC3抗体对LC3-II有更高的亲和力,会造成假阳性。方法1和3需结合使用,同时需考虑溶酶体活性的影响。)
A19665 [KO Validated] LC3B Rabbit mAb
自噬发生时,p62与LC3蛋白可发生荧光共定位,并且,在Co-IP中发生蛋白共沉淀且细胞质中蛋白会被不断降解;而当自噬活性减弱或者自噬系统受损时,p62蛋白会在细胞质中不断积累,因而p62也是反映自噬活性的重要标记蛋白之一,其蛋白含量间接反映自噬小体清除水平,与自噬流呈负相关。
A19700 [KO Validated] SQSTM1 / p62 Rabbit mAb
➤方法二:利用激光共聚焦显微镜检测自噬体与其他细胞器的融合 在研究自噬相关蛋白时,需对其进行定位。由于自噬体与溶酶体、线粒体、内质网、高尔基体关系密切,为了区别,常用到一些示踪蛋白在荧光显微镜下来共定位: Hsp60:定位于线粒体基质,细胞死亡时不会被释放。
A0564 Hsp60 Rabbit mAb
Calreticulin(钙网织蛋白,CALR):内质网腔。
A1066 CALR Rabbit pAb
Lamp-2:溶酶体膜蛋白,可用于监测自噬体与溶酶体融合。 pDsRed2-mito:载体,转染后表达一个融合蛋白(红色荧光蛋白+线粒体基质定位信号),可用来检测线粒体被自噬掉的程度(Mitophagy)。MitoTraker探针:特异性显示活的线粒体,荧光在经过固定后还能保留。
➤方法三:荧光显微镜下采用GFP-LC3融合蛋白来示踪自噬形成 由于电镜耗时长,不利于监测(Monitoring)自噬形成,人们利用LC3在自噬形成过程中发生聚集的现象开发出了此技术。无自噬时,GFP-LC3融合蛋白弥散在胞浆中;自噬形成时,GFP-LC3融合蛋白转位至自噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,可以通过计数来评价自噬活性的高低。
➤方法四:观察自噬体的形成 由于自噬体属于亚细胞结构,普通光镜下看不到,因此,直接观察自噬体需在透射电镜下。Phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2)的特征为:单层膜,胞浆成分已降解。(autophagic vacuole,AV)
3.自噬的上游调节通路和关键蛋白
图4:自噬相关通路
4.自噬常用的激活剂和抑制剂 正常培养的细胞自噬活性很低,不适于观察,因此,必须对自噬进行人工干预和调节,经报道的工具药有: (一)自噬诱导剂 1)药物诱导 2)其他模型,如感染、DNA损伤、缺氧、H2O2等。
图5:自噬诱导类药物
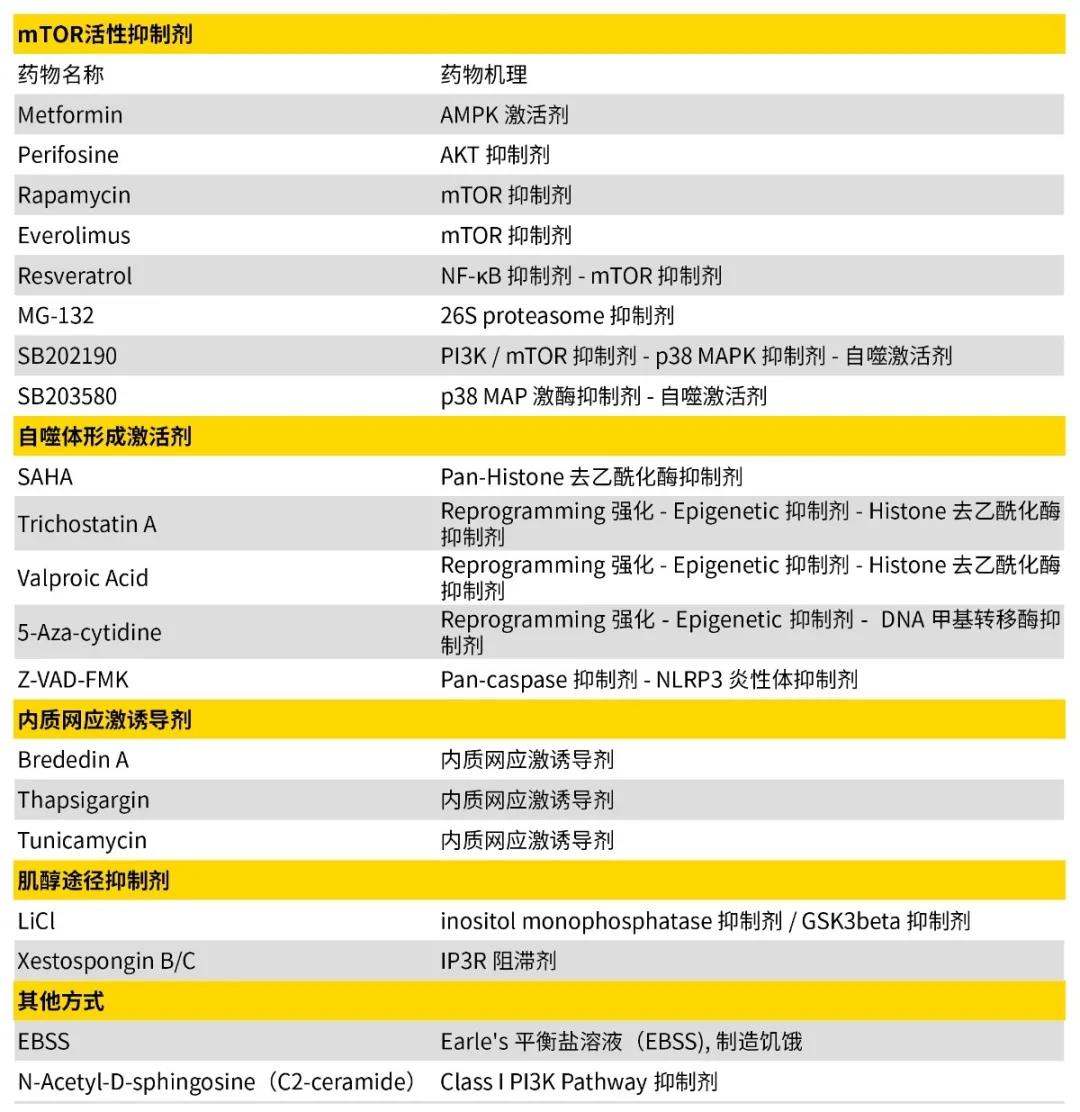
(二)自噬抑制剂 1)药物诱导 2)其他方法,如利用突变株、反义RNA干扰技术(Knockdown)、基因缺失技术、外源基因导入等。
图6: 自噬抑制类药物
>>>>文献参考 1.Mizushima, N., et.al (2008). Nature 451, 1069-1075. 2.Nakatogawa, H.,et.al (2009). Nat. Rev. Mol. Cell Biol. 10, 458-467. 3.Xie, Z. and Klionsky, D. J. (2007). Nat. Cell Biol. 9, 1102-1109. 4.Levine B, Klionsky DJ. Dev. Cell 2004;6:463. 5.Klionsky, DJ., editor. Autophagy. Landes Bioscience; Georgetown, TX: 2004. p. 1-303. 6.Tsukada, M. and Ohsumi, Y. (1993). FEBS Lett. 333,169-174. 7.Jung CH, et al. (2009). Mol Biol Cell 20:1992-2003. 8.Mizushima N (2010). Curr Opin Cell Biol 22: 132-139. 9.Pattingre S, et.al (2008). Biochimie 90: 313-323. 10.Russell,RC. et al. (2013). Nat Cell Biol. 15: 741-750. 11.Matsushita M, et.al (2007). J Biol Chem 282: 6763-6772.
|
【本文地址】