一文理清EC、EMA、HMA, NCA及EDQM在欧洲药品注册中的职能和关系 |
您所在的位置:网站首页 › ema线代表什么意思 › 一文理清EC、EMA、HMA, NCA及EDQM在欧洲药品注册中的职能和关系 |
一文理清EC、EMA、HMA, NCA及EDQM在欧洲药品注册中的职能和关系
|
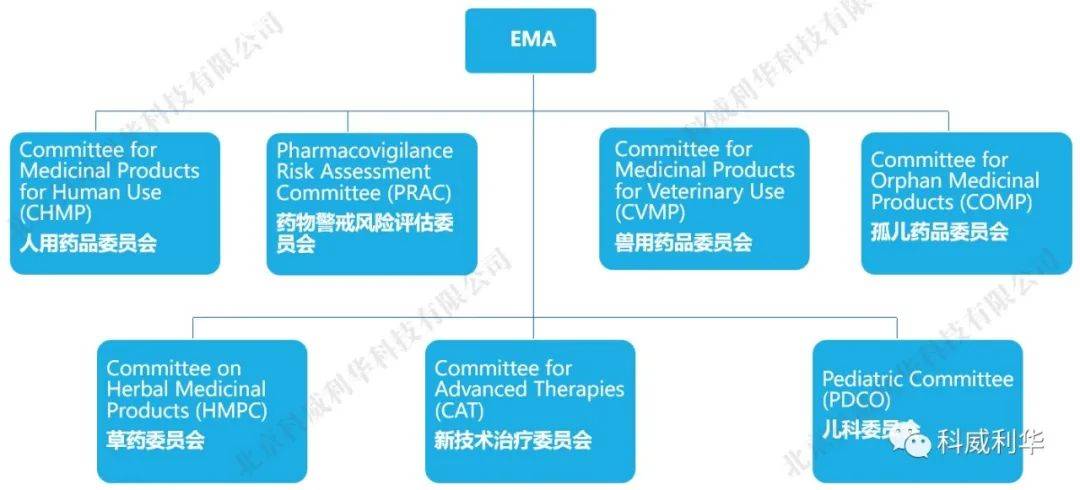
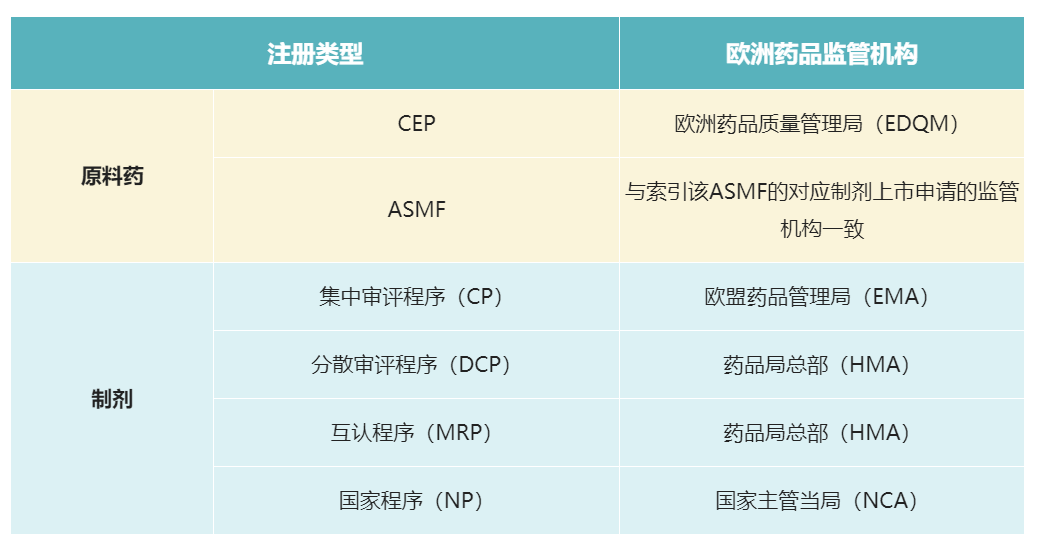
其中,最为熟悉的是人用药品委员会(CHMP),其负责欧盟市场药品申请集中程序(CP)的审评;同时,当分散审评程序(DCP)和互认程序(MRP)出现成员国意见不一致时,由CHMP负责协调。 EMA为整个欧盟药品监管的最高机构,由各成员国代表充当EMA委员会的成员,其主要职能是: - 负责欧盟市场药品申请集中程序(CP)的审评,评估药品科学研究,监督药品在欧盟的安全性、有效性; - 负责协调、检查、监督各成员国的GXP检查,包括GAP、GMP、GLP、GCP、GDP等; - 解决纠纷,协调递交到委员会的药品科学评价意见,并在欧盟内部促进科学技术的创新、发展和交流。 4. 国家主管当局(NCA)除了欧盟层面对药品上市申请的审批及对药品质量的监管进行统一组织协调外,欧盟各成员国也均有各自的国家主管当局(National Competent Authority, NCA),其主要职能有: - 负责审批国家程序(NP)的药品上市申请; - 作为主审国或参审国参与分散审评程序(DCP)的药品上市申请审批; - 负责药物安全监控; - 执行GXP检查。 5. 药品局总部(HMA)药品局总部(Heads of Medicines Agencies, HMA)是由国家主管当局(NCA)负责人组成,与欧盟药品管理局(EMA)和欧盟委员会(EC)合作运营欧盟药品监管网络。 HMA由一个管理组协调和监督,并得到多个工作组及常设秘书处的支持,负责欧洲经济区人用和兽用药品的监管,并在人用和兽用药品监管领域分别设立了协调组织,分别为人用药互认程序和分散审评程序协调组(CMDh)和兽药互认程序和分散审评程序协调组(CMDv),主要负责审查和协调在互认程序和分散审评程序中与两个或多个成员国的药品上市许可有关的问题。 简而言之,HMA的职能主要有: - 解决欧盟药品监管网络的关键战略问题,例如信息交流、IT发展和最佳实践共享; - 专注于欧盟药品监管体系的开发、协调和一致性; - 确保最有效和高效地使用整个欧盟药品监管网络的资源,包括制定和监督工作共享安排; - 协调互认程序(MRP)和分散审评程序(DCP)。 6. 欧洲药品质量管理局(EDQM)欧洲药品质量管理局(European directorate for quality of medicines and health care, EDQM),其创立于1964年,原名称为“European Pharmacopoeia Secretariat”,隶属于1949年创立的欧洲委员会(Council of Europe),1996年经欧共体与欧洲议会协商后,以设在法国的欧洲药典委员会秘书处为基础成立了欧洲药品质量管理局(EDQM)。 相较于EMA、HMA、NCA等欧盟监管机构,EDQM更为独立,也得到了很多非欧盟国家的认可和接受。EDQM的标准在《欧洲药典》中发布,该标准在世界范围内被视为科学基准,在成员国具有法律约力。 EDQM具体职能主要有: (1)为欧洲药典委员会的技术秘书处提供技术支持; (2)负责欧洲药典及相关产品的出版与发行; (3)负责化学药物标准品和生物制品标准品的制备与销售; (4)负责对欧洲药典各论的适用性认证申请进行审评,颁发CEP证书,以及协调相关现场审查的工作; (5)负责构建欧洲官方药品检验实验室网络,承担生物制品批签发与上市药品的监督任务; (6)协调欧洲委员会成员国输血及器官移植工作的指导原则与建议的起草; (7) 在药品制备与治疗领域内,协调与药品质量与安全使用相关的程序与政策的起草;在假冒药品方面,协调风险预防和管理;在药品供应方面,协调其分类。 7. 结语综上所述,对于欧洲药品申报,不同的注册类型对应不同的药品监管机构,具体总结如下:
|
【本文地址】
 返回搜狐,查看更多
返回搜狐,查看更多