|
很少有人预测到X射线计算机断层扫描(CT)技术的巨大发展,甚至更少有人在20世纪80年代末就预见到CT临床应用的快速发展。事实上,人们对磁共振(MR)成像热情如此之高,以至于MR取代CT成像的预测被许多人接受。30多年后的今天,CT不仅经受住了来自其他成像方式的挑战,而且已经走到医院诊断成像的前线。 促成CT成功的因素很多,总结过去30年的技术进步有多种方法。这些进步可以根据其临床影响、性能改进或底层技术本身进行检验。从临床影响的角度来看,冠状动脉CT血管造影(CCTA)无疑是许多技术发展的主要驱动力之一。它需要快速的数据采集来冻结心脏运动,更高的空间分辨率来描述小的病变,以及足够的覆盖范围,以便能够在一个或几个心动周期内对整个心脏进行成像。多年来几乎所有的技术进步都以某种方式促成了CCTA今天的成功。当然,对其他临床应用的严格要求,如创伤、肿瘤和卒中,也对技术发展起到了关键作用。从CT性能的角度来看,技术进步可以按时间顺序分为三大类:各向同性的容积覆盖、卓越的时间分辨率和用于材料分类和区分的光谱信息。最初的CT发展主要集中在为静态物体生成良好的图像:通过引入螺旋采集实现一次屏气全器官覆盖,随后通过引入多层CT实现全身的各向同性空间分辨率。下一个发展前沿主要集中在扫描的时间方面:通过更快的机架旋转、宽锥CT(wide-cone CT)、双源CT(DSCT)、更大的螺距和先进的算法,冻结患者运动并获得更大扫描范围的动态信息。CT发展的第三个前沿是在纯粹的解剖成像之后,通过利用双能量或多能量数据采集为CT图像提供 "色彩"。这些数据采集模式建立在各向同性容积覆盖范围和时间分辨率改进类别的所有先前进展的基础上。从底层技术的角度来看,CT的发展可分为五大类:螺旋数据采集、多层CT、宽锥CT、DSCT和光谱CT。尽管不同类别之间存在一些重叠,但与临床影响的角度或性能角度相比,这种分离更加清晰。因此,我们采用这种方法来概述CT的发展历史。本文的第二个目的是提供一个关于CT的未来前景。毋庸置疑,未来的技术既令人兴奋又多样化。如今,人工智能(AI)和深度学习技术已经并将继续成为推动CT前进的强大工具和颠覆性技术。AI支持的CT扫描工作流程的改进和自动化以及增强CT图像临床信息的方法改变了技术人员和放射科医生的工作方式。作为标准图像重建任务的一部分,现代CT扫描仪提供与解剖结构一致的重建和高级可视化,甚至病理过程的自动识别和量化也正在常规集成到CT工作流程中。在信息展示方面,增材制造(或3D打印)将继续影响放射科医生与其他医疗专业人员和患者
的
互动
方式。
虚拟现实和增强现实的快速发展已经并将继续影响放射科,从培训到操作,以及新的工作流程。
有趣的是,尽管有所有的技术进步和改进,所有现代CT扫描仪仍然基于第三代旋转-旋转的几何结构。
X射线管技术有了新的发展,可以将多个X射线源放置在同一个CT机架上,并可能导致新一代CT扫描仪具有更少或无机械运动。
其他方法,如相位对比CT,最近在科学文献中获得了相当大的关注(参见:
下一代CT硬件技术及在心脏成像中的应用
),但尚未导致临床上可用的全身CT系统。
这个名单可以一直列下去。
鉴于本评论文章的范围有限,不可能涵盖使CT增长的所有方面。
因此,最后一节仅致力于即将到来的CT技术之一:
光子计数CT。螺旋CT 1990年,主要供应商推出了通过滑环技术实现连续机架旋转的CT扫描仪和数据采集期间的连续患者传输。这种所谓的螺旋数据采集构成了CT成像技术发展和持续改进的基本进化步骤。第一次,容积数据变得可用:整个器官可以在一次屏气中覆盖而不会造成解剖细节的错误配准,并且可以在任意位置重建重叠图像。与之前的步骤和拍摄数据采集技术相比,这是一项重大成就,该技术仅为感兴趣的器官提供了几个切片。容积数据成为CT血管造影等应用的基础,CT血管造影已经彻底改变了血管疾病的评估。获取容积数据的能力也为使用3D图像处理技术铺平了道路,例如CT中的多平面重建,最大密度投影,表面遮盖显示或容积渲染技术(VRT)。 
图1 使用算法360-LI对黑色圆圈平面进行螺旋插值。 螺旋CT引入后,对图像重建提出了新的要求。螺旋CT中的扫描几何是非平面的。球管不会在圆形路径上移动,而是沿着螺旋路径移动。在螺旋CT中,可以通过无量纲图形来方便地表征检查床的运动。所谓螺距(Pitch)
定义为每次旋转进床
量与准直光束宽度的比率。
在图1中,焦点的螺旋路径以3D视图显示。
黑色圆圈表示在相应平面中图像重建所需的所有焦点的位置。
不幸的是,该平面中的测量数据仅适用于一个投影角:
螺旋路径与黑色圆圈的交点。
对于图像重建,我们需要为其他投影角度以及位置*提供数据。
对于这个角度,测量数据可在感兴趣平面前面和后面的Z轴位置获得。
位置*处的数据可以通过沿连接图1中由o,*和o标记的点的线的线性插值(360-LI)获得。360-LI算法计算简单,但它有一些缺点。由于该360-LI算法的插值输入(partners)相距360度,因此需要从参考平面前360度到参考平面后360度的数据。总的来说,这包括720度的数据范围。由于插值输入(partners)之间的距离较大,这在高螺距中引入了挑战。为了减小这个距离,需要识别更靠近参考平面的插值输入(partners)。实际上,对于每个射线,当X射线管和探测器互换它们的位置时,在大约半圈旋转之后已经可以使用插值输入(partners)。这就是所谓的“互补射线”,依赖于直接和互补射线的螺旋插值方案称为180-LI。由于螺旋插值,切片轮廓从梯形变化,在某些情况下从几乎从轴向序列扫描已知的矩形变为更接近钟形的曲线,如图2所示。180-LI算法导致比360-LI更窄,更好定义的切片轮廓,但代价是图像噪声增加。360-LI的图像噪声低于序列采集;而180-LI的图像噪声比序列扫描更高。 图2 螺旋CT中的有效切片宽度:以红色表示的准直切片轮廓为梯形。螺旋插值后的切片轮廓为钟形(不同螺距值下最常用的180-LI方法见绿色曲线)。Z轴分辨率不再仅由准直的光束宽度(如轴向序列扫描)决定,而是由螺旋插值的结果产生的有效切片宽度决定。通常,SEFFI定义为切片灵敏度曲线的半峰全宽(FWHM)。对于360-LI和180-LI,SEFF随着螺距的增加而增加,尽管180-LI要少得多。这是用于螺旋插值的投影的纵向距离增加的结果。图3显示了临床螺旋CT扫描的早期示例。 图2 螺旋CT中的有效切片宽度:以红色表示的准直切片轮廓为梯形。螺旋插值后的切片轮廓为钟形(不同螺距值下最常用的180-LI方法见绿色曲线)。Z轴分辨率不再仅由准直的光束宽度(如轴向序列扫描)决定,而是由螺旋插值的结果产生的有效切片宽度决定。通常,SEFFI定义为切片灵敏度曲线的半峰全宽(FWHM)。对于360-LI和180-LI,SEFF随着螺距的增加而增加,尽管180-LI要少得多。这是用于螺旋插值的投影的纵向距离增加的结果。图3显示了临床螺旋CT扫描的早期示例。 图3 1989年RSNA首次对肺部进行螺旋CT扫描(由Willi Kalender提供)。多层螺旋CT螺旋CT的引入使得单次屏气即可覆盖器官。然而,当沿患者纵轴(z轴)的器官尺寸较大时,我们不得不在z轴上的覆盖量和空间分辨率(切片厚度)之间进行权衡。随着所需容积覆盖率的增加,重建图像的切片厚度几乎呈线性增加。为便于说明,图4描绘了z轴覆盖作为机架旋转速度为1.0 s且患者屏气时间为20 s的CT系统的螺距函数。对于小器官,如z轴跨度约为30 mm的内耳道,螺距为1.5(黑色曲线),切片厚度为1 mm。然而,对于z轴上300 mm的典型跨度的完整肺覆盖,需要将图像切片厚度增加到10 mm(绿色曲线),而需要使用>1.5的螺距。 图3 1989年RSNA首次对肺部进行螺旋CT扫描(由Willi Kalender提供)。多层螺旋CT螺旋CT的引入使得单次屏气即可覆盖器官。然而,当沿患者纵轴(z轴)的器官尺寸较大时,我们不得不在z轴上的覆盖量和空间分辨率(切片厚度)之间进行权衡。随着所需容积覆盖率的增加,重建图像的切片厚度几乎呈线性增加。为便于说明,图4描绘了z轴覆盖作为机架旋转速度为1.0 s且患者屏气时间为20 s的CT系统的螺距函数。对于小器官,如z轴跨度约为30 mm的内耳道,螺距为1.5(黑色曲线),切片厚度为1 mm。然而,对于z轴上300 mm的典型跨度的完整肺覆盖,需要将图像切片厚度增加到10 mm(绿色曲线),而需要使用>1.5的螺距。 图4 Z轴覆盖作为螺旋CT螺距的函数,以1s机架旋转速度屏气20秒。这种权衡源于这样一个事实,即单层 CT 系统的层厚主要由患者前准直的宽度(因此是 X 射线束的宽度)决定,如图 5(a) 所示,因为探测器无法区分沿 z 方向的 X 射线相互作用的位置。在探测器单元中记录的所有X射线光子将被加在一起,而不管它们落在何处。当每个投影都需要覆盖较大的容积时,层厚自然会受到影响。如图5(b)所示,可以通过修改探测器设计来减少或消除这种约束,使得图像的层厚独立于X射线束宽度。此图显示了一个八层CT探测器,其中每个原始单层探测器单元分为八个部分,每个元素独立读取。因此,X射线光子的z轴位置由单个探测器单元识别,使得图像的层厚变得独立于X射线束宽度。 图4 Z轴覆盖作为螺旋CT螺距的函数,以1s机架旋转速度屏气20秒。这种权衡源于这样一个事实,即单层 CT 系统的层厚主要由患者前准直的宽度(因此是 X 射线束的宽度)决定,如图 5(a) 所示,因为探测器无法区分沿 z 方向的 X 射线相互作用的位置。在探测器单元中记录的所有X射线光子将被加在一起,而不管它们落在何处。当每个投影都需要覆盖较大的容积时,层厚自然会受到影响。如图5(b)所示,可以通过修改探测器设计来减少或消除这种约束,使得图像的层厚独立于X射线束宽度。此图显示了一个八层CT探测器,其中每个原始单层探测器单元分为八个部分,每个元素独立读取。因此,X射线光子的z轴位置由单个探测器单元识别,使得图像的层厚变得独立于X射线束宽度。 图5 不同CT几何图形的图示:(a)单层CT和(b)八层CT。对于单层配置,层厚由患者前准直(光束宽度)定义,而对于多层系统,层厚由探测器行宽度决定。尽管一些早期的CT扫描仪有两排探测器,从1971年的第一台CT扫描仪开始,到1992年推出的两排扫描仪(Elscint CT Twin),人们普遍认为,对临床实践产生重大影响的多层扫描仪是在1998年推出的,当时四排探测器CT系统已在临床上可用。从那时起,探测器排数迅速从4增加到8、16、32和64。随着探测器排数的增加,探测器排的宽度(z)也从1 mm以上减少到亚毫米。值得指出的是,在多排探测器设计的早期,探测器行宽度不一定等宽。例如,16排探测器CT可能在中心包含16个亚毫米探测器行,在两侧包含8个宽度加倍的探测器行。当需要亚毫米成像时,患者前准直器限制X射线束宽度,以便仅照射中心16排亚毫米探测器。当需要更宽的覆盖范围时,患者前准直器打开以照亮所有探测器,中心的亚毫米行成对相加以匹配外部探测器行宽度。这种设计不一定是出于选择,主要是受电子封装和数据传输带宽的限制。然而,随着64排探测器的引入,混合模式探测器的设计几乎消失。对于MDCT,与单层CT相比,重建算法更加复杂。研究活动集中于减少序列扫描模式数据采集的锥束相关伪影,以及螺旋数据采集的“精确”重建算法。图6中描绘了说明锥束伪影的示例。对于在序列采集中使用中心探测器行获取的图像[图6(a)],可以近似假设由这些行探测到的X射线光子平行于x−y平面,而对于在边缘行获取的图像,X射线光子相对于X射线以倾斜角度传播−这样的近似不再有效。锥束效应随着z轴方向探测器覆盖范围的增加而增加。因此,重建算法已从二维扩展到三维,需要额外的补偿来解释数据采集中丢失的信息。 图5 不同CT几何图形的图示:(a)单层CT和(b)八层CT。对于单层配置,层厚由患者前准直(光束宽度)定义,而对于多层系统,层厚由探测器行宽度决定。尽管一些早期的CT扫描仪有两排探测器,从1971年的第一台CT扫描仪开始,到1992年推出的两排扫描仪(Elscint CT Twin),人们普遍认为,对临床实践产生重大影响的多层扫描仪是在1998年推出的,当时四排探测器CT系统已在临床上可用。从那时起,探测器排数迅速从4增加到8、16、32和64。随着探测器排数的增加,探测器排的宽度(z)也从1 mm以上减少到亚毫米。值得指出的是,在多排探测器设计的早期,探测器行宽度不一定等宽。例如,16排探测器CT可能在中心包含16个亚毫米探测器行,在两侧包含8个宽度加倍的探测器行。当需要亚毫米成像时,患者前准直器限制X射线束宽度,以便仅照射中心16排亚毫米探测器。当需要更宽的覆盖范围时,患者前准直器打开以照亮所有探测器,中心的亚毫米行成对相加以匹配外部探测器行宽度。这种设计不一定是出于选择,主要是受电子封装和数据传输带宽的限制。然而,随着64排探测器的引入,混合模式探测器的设计几乎消失。对于MDCT,与单层CT相比,重建算法更加复杂。研究活动集中于减少序列扫描模式数据采集的锥束相关伪影,以及螺旋数据采集的“精确”重建算法。图6中描绘了说明锥束伪影的示例。对于在序列采集中使用中心探测器行获取的图像[图6(a)],可以近似假设由这些行探测到的X射线光子平行于x−y平面,而对于在边缘行获取的图像,X射线光子相对于X射线以倾斜角度传播−这样的近似不再有效。锥束效应随着z轴方向探测器覆盖范围的增加而增加。因此,重建算法已从二维扩展到三维,需要额外的补偿来解释数据采集中丢失的信息。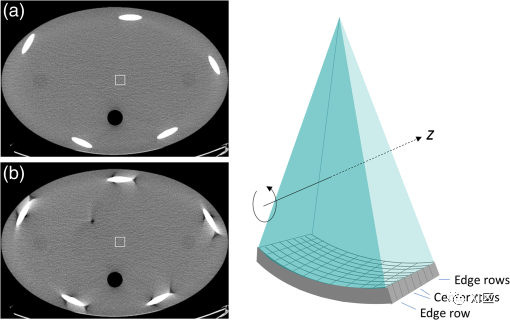 图6 带有螺旋体模型的锥束伪影图示。图像是在序列模式数据采集中采集的(a) 中心行位置和图像以及(b)边缘行位置。随着多层CT的引入,在x、y和z方向上获得各向同性空间分辨率的目标已逐渐实现。历史上,平面内空间分辨率(x−y) 比z轴分辨率要好得多。在早期的CT检查中,这种差异不是问题,因为主要是在轴位方向上观察图像。随着多层CT的引入,尤其是探测器排数达到或超过16排时,图像以3D方式查看。例如,矢状面(y−z平面),冠状面(x−z平面)和容积渲染的图像已经获得了极大的普及,并且由放射科医生常规查看。如图7所示。 图6 带有螺旋体模型的锥束伪影图示。图像是在序列模式数据采集中采集的(a) 中心行位置和图像以及(b)边缘行位置。随着多层CT的引入,在x、y和z方向上获得各向同性空间分辨率的目标已逐渐实现。历史上,平面内空间分辨率(x−y) 比z轴分辨率要好得多。在早期的CT检查中,这种差异不是问题,因为主要是在轴位方向上观察图像。随着多层CT的引入,尤其是探测器排数达到或超过16排时,图像以3D方式查看。例如,矢状面(y−z平面),冠状面(x−z平面)和容积渲染的图像已经获得了极大的普及,并且由放射科医生常规查看。如图7所示。 图7 在64层CT扫描仪上获得的临床图像(a)腹部和骨盆研究的冠状位图像,以及(b)颈动脉的容积渲染图像和Willis 环CTA检查。宽锥CT
多层螺旋CT的引入使器官覆盖具有各向同性的空间分辨率。对于时间敏感的临床应用,如CCTA,在一次旋转中捕获整个器官的能力非常重要。尽管64排CT扫描仪可以获得良好的CCTA图像,但获得的图像质量在很大程度上取决于患者心率和稳定性。心脏的平均长度为12厘米,为了覆盖整个心脏,需要多次旋转,因此需要多个心动周期扫描。对于中等心率,提出了一种序列数据采集模式,其中在多个心动周期内执行一系列略微重叠的轴向数据采集,以实现低剂量心脏成像。当心率较高且心律不齐时,通常使用称为多扇区重建的技术。在这种情况下,使用小螺距(通常约为0.2)以便可以使用在多个心动周期中收集的数据重建图像,每个周期贡献重建所需数据的一小部分。由于在每个心脏周期中收集的数据只是整体所需半扫描的一小部分,因此在增加辐射剂量的情况下,可以实现时间分辨率的提高。然而,由于各种硬件限制,单扇区或多扇区方法都不完美。在这两种方法中都可以找到次优图像质量的临床例子。图8(b)描述了多个心动周期内心脏运动不一致导致的带状伪影示例。 图7 在64层CT扫描仪上获得的临床图像(a)腹部和骨盆研究的冠状位图像,以及(b)颈动脉的容积渲染图像和Willis 环CTA检查。宽锥CT
多层螺旋CT的引入使器官覆盖具有各向同性的空间分辨率。对于时间敏感的临床应用,如CCTA,在一次旋转中捕获整个器官的能力非常重要。尽管64排CT扫描仪可以获得良好的CCTA图像,但获得的图像质量在很大程度上取决于患者心率和稳定性。心脏的平均长度为12厘米,为了覆盖整个心脏,需要多次旋转,因此需要多个心动周期扫描。对于中等心率,提出了一种序列数据采集模式,其中在多个心动周期内执行一系列略微重叠的轴向数据采集,以实现低剂量心脏成像。当心率较高且心律不齐时,通常使用称为多扇区重建的技术。在这种情况下,使用小螺距(通常约为0.2)以便可以使用在多个心动周期中收集的数据重建图像,每个周期贡献重建所需数据的一小部分。由于在每个心脏周期中收集的数据只是整体所需半扫描的一小部分,因此在增加辐射剂量的情况下,可以实现时间分辨率的提高。然而,由于各种硬件限制,单扇区或多扇区方法都不完美。在这两种方法中都可以找到次优图像质量的临床例子。图8(b)描述了多个心动周期内心脏运动不一致导致的带状伪影示例。 图8 窄探测器对CCTA成像的影响 。(a)探测器只覆盖心脏的一小部分,需要多次采集才能实现完全覆盖;(b)在16排探测器上采集的CCTA示例,相位错位(红色箭头)。如果z轴方向中的探测器覆盖范围足够大,足以覆盖整个心脏,则所有成像数据将在单个心动周期内收集。在这种安排下,由于整个心脏都是在一个心动周期内获得的,因此心脏相位没有不一致性。图9描述了心率变化显著的患者CCTA检查(检查期间为38至111 bpm)。此外,在初始数据采集期间检测到心律失常。由于在整个数据采集过程中,患者检查床保持静止,因此暂停X射线照射,直到检测到正常心率。尽管患者心率不稳定,但仍能获得出色的图像质量。 图8 窄探测器对CCTA成像的影响 。(a)探测器只覆盖心脏的一小部分,需要多次采集才能实现完全覆盖;(b)在16排探测器上采集的CCTA示例,相位错位(红色箭头)。如果z轴方向中的探测器覆盖范围足够大,足以覆盖整个心脏,则所有成像数据将在单个心动周期内收集。在这种安排下,由于整个心脏都是在一个心动周期内获得的,因此心脏相位没有不一致性。图9描述了心率变化显著的患者CCTA检查(检查期间为38至111 bpm)。此外,在初始数据采集期间检测到心律失常。由于在整个数据采集过程中,患者检查床保持静止,因此暂停X射线照射,直到检测到正常心率。尽管患者心率不稳定,但仍能获得出色的图像质量。 图9 在16厘米探测器系统上以0.6 mSv在一个心动周期内采集的心率在38到111 bpm之间的心律失常患者的CCTA图像。(a)三维体渲染图像(b)左前降支(LAD)的重组图像;和(c)右冠状动脉(RCA)的CPR图像。图片由瑞士苏黎世USZ考夫曼教授提供。当然,CCTA成像只是得益于宽z轴覆盖探测器的临床示例之一。其他临床益处,如体积灌注和剂量减少,已被研究人员证明。在相同的螺旋螺距和机架旋转速度下,更大的覆盖范围探测器允许更快的z覆盖,这可以最大限度地减少与患者运动相关的问题,并放松成人患者的屏气要求和儿科患者的镇静要求。图10描述了一名3岁未服用镇静剂的儿童患者的检查。尽管心率很高(117 bpm),但获得了极好的图像质量。这项检查是在门控轴向数据采集中使用16厘米探测器系统进行的。鉴于患者体型较小,在
CTDIvol
1.3 mGy
时,使用70 kV优化剂量性能。 图9 在16厘米探测器系统上以0.6 mSv在一个心动周期内采集的心率在38到111 bpm之间的心律失常患者的CCTA图像。(a)三维体渲染图像(b)左前降支(LAD)的重组图像;和(c)右冠状动脉(RCA)的CPR图像。图片由瑞士苏黎世USZ考夫曼教授提供。当然,CCTA成像只是得益于宽z轴覆盖探测器的临床示例之一。其他临床益处,如体积灌注和剂量减少,已被研究人员证明。在相同的螺旋螺距和机架旋转速度下,更大的覆盖范围探测器允许更快的z覆盖,这可以最大限度地减少与患者运动相关的问题,并放松成人患者的屏气要求和儿科患者的镇静要求。图10描述了一名3岁未服用镇静剂的儿童患者的检查。尽管心率很高(117 bpm),但获得了极好的图像质量。这项检查是在门控轴向数据采集中使用16厘米探测器系统进行的。鉴于患者体型较小,在
CTDIvol
1.3 mGy
时,使用70 kV优化剂量性能。 图10 3岁儿童患者未经镇静(心率117 bpm)成像的示例。使用70 kV的16 cm门控轴向数据采集(CTDIvol=1.3mGy)(a) 肺窗显示的轴位图像(b) 通过软组织窗口显示轴向图像;(c)软组织窗口显示的冠状图像。然而,宽锥CT系统存在技术挑战。其中一个挑战是散射辐射。众所周知,散射量,更准确地说是散射与主射线比,几乎与轴方向的覆盖率成线性增加。因此,宽锥CT系统需要适当的补偿。解决方案可以来自硬件设计或算法修正。例如,由于散射X射线光子向所有方向传播,因此散射辐射的抑制不应限于x−y平面。利用二维聚焦后准直,可以有效地减少或消除沿z方向的散射辐射。图11说明了沿z轴散射的影响。使用1D准直器时(主要排除X射线中的散射辐射−可以观察到由于沿z方向的散射辐射而产生的阴影和伪影[图11(a)]。分散处理可采用预防或纠正方法。例如,通过采用2D聚焦准直,可以防止散射辐射的很大一部分到达CT探测器,并且可以显著抑制图像伪影[图11(b)]。另一方面,开发了许多算法来补偿散射引起的图像伪影。 图10 3岁儿童患者未经镇静(心率117 bpm)成像的示例。使用70 kV的16 cm门控轴向数据采集(CTDIvol=1.3mGy)(a) 肺窗显示的轴位图像(b) 通过软组织窗口显示轴向图像;(c)软组织窗口显示的冠状图像。然而,宽锥CT系统存在技术挑战。其中一个挑战是散射辐射。众所周知,散射量,更准确地说是散射与主射线比,几乎与轴方向的覆盖率成线性增加。因此,宽锥CT系统需要适当的补偿。解决方案可以来自硬件设计或算法修正。例如,由于散射X射线光子向所有方向传播,因此散射辐射的抑制不应限于x−y平面。利用二维聚焦后准直,可以有效地减少或消除沿z方向的散射辐射。图11说明了沿z轴散射的影响。使用1D准直器时(主要排除X射线中的散射辐射−可以观察到由于沿z方向的散射辐射而产生的阴影和伪影[图11(a)]。分散处理可采用预防或纠正方法。例如,通过采用2D聚焦准直,可以防止散射辐射的很大一部分到达CT探测器,并且可以显著抑制图像伪影[图11(b)]。另一方面,开发了许多算法来补偿散射引起的图像伪影。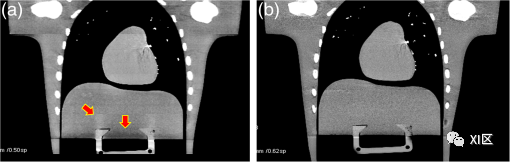 图11 散射辐射的影响和散射抑制的硬件方法说明:(a)在1D患者后准直系统上获取的图像,红色箭头指示散射伪影;(b)在2D聚焦准直系统上获取的图像,在z方向上具有额外的散射抑制。另一个技术挑战是处理与大锥角相关的伪影。对于数据采集序列扫描模式,偏离中心的图像位置处缺失的频域信息量随着距离中心平面的距离而增加,并且采样频率形状类似于圆环。此外,在半扫描数据采集的情况下,正确处理冗余信息也同样重要。在扇束数据采集(单个切片)的情况下,应用加权函数以确保冗余数据的贡献总和统一。宽锥系统的补偿需要更加复杂,以确保冗余频率信息得到适当补偿。如果没有采取适当的注意,可以观察到图像伪影,如图12(a)所示,其中使用简单的FDK重建算法来重建计算机模拟体模。已经对宽锥重建算法进行了广泛的研究,补偿缺失频率和冗余样本的高级算法能够显著减少或消除伪影,如图12(b)所示。更多内容参见:理想的CT,探测器应该多宽? 图11 散射辐射的影响和散射抑制的硬件方法说明:(a)在1D患者后准直系统上获取的图像,红色箭头指示散射伪影;(b)在2D聚焦准直系统上获取的图像,在z方向上具有额外的散射抑制。另一个技术挑战是处理与大锥角相关的伪影。对于数据采集序列扫描模式,偏离中心的图像位置处缺失的频域信息量随着距离中心平面的距离而增加,并且采样频率形状类似于圆环。此外,在半扫描数据采集的情况下,正确处理冗余信息也同样重要。在扇束数据采集(单个切片)的情况下,应用加权函数以确保冗余数据的贡献总和统一。宽锥系统的补偿需要更加复杂,以确保冗余频率信息得到适当补偿。如果没有采取适当的注意,可以观察到图像伪影,如图12(a)所示,其中使用简单的FDK重建算法来重建计算机模拟体模。已经对宽锥重建算法进行了广泛的研究,补偿缺失频率和冗余样本的高级算法能够显著减少或消除伪影,如图12(b)所示。更多内容参见:理想的CT,探测器应该多宽? 图12 胸部模型计算机模拟的重建图像:(a)使用FDK重建算法的锥形束伪影(红色箭头)说明和(b)使用更先进的重建算法的伪影抑制。双源CT对于心率较高且不规则的患者,稳健的CCTA需要良好的时间分辨率。CT的时间分辨率是获取足够数据以重建轴向图像所需的时间。这大约是等中心附近图像像素机架旋转时间的一半,心脏通常位于等中心(所谓的半扫描)。时间分辨率不应与CT扫描的总扫描时间混淆。在过去30年中,CT系统的速度越来越快。然而,由于离心力大幅增加造成的机械挑战,无法实现小于0.25 s的机架旋转时间,从而导致125 ms的时间分辨率。提供增强的时间分辨率但不需要更快机架旋转的另一种扫描仪概念是DSCT;这是一个CT系统,具有两个X射线管和大约90度角的相应探测器。两个测量系统在患者的同一解剖水平上同时获取CT扫描数据。自2006年以来,三代DSCT系统已投入商业使用(见图13)。 图12 胸部模型计算机模拟的重建图像:(a)使用FDK重建算法的锥形束伪影(红色箭头)说明和(b)使用更先进的重建算法的伪影抑制。双源CT对于心率较高且不规则的患者,稳健的CCTA需要良好的时间分辨率。CT的时间分辨率是获取足够数据以重建轴向图像所需的时间。这大约是等中心附近图像像素机架旋转时间的一半,心脏通常位于等中心(所谓的半扫描)。时间分辨率不应与CT扫描的总扫描时间混淆。在过去30年中,CT系统的速度越来越快。然而,由于离心力大幅增加造成的机械挑战,无法实现小于0.25 s的机架旋转时间,从而导致125 ms的时间分辨率。提供增强的时间分辨率但不需要更快机架旋转的另一种扫描仪概念是DSCT;这是一个CT系统,具有两个X射线管和大约90度角的相应探测器。两个测量系统在患者的同一解剖水平上同时获取CT扫描数据。自2006年以来,三代DSCT系统已投入商业使用(见图13)。 图13 具有两个独立测量系统的DSCT:(a)第一代,系统角度为90度;(b)第二代,为了将探测器B的SFOV增加到33厘米,选择了95度的较大系统角度。第三代DSCT(c),探测器B的SFOV进一步增加至35.5 cm。DSCT实现的时间分辨率约为机架旋转时间的四分之一。每个测量系统仅获取约90度的扫描数据,两个数据段都附加到靠近等中心的图像重建所需的半扫描中。DSCT提供时间分辨率远低于100 ms的图像。例如,具有0.25 s机架旋转时间的第三代DSCT可实现66 ms的时间分辨率。时间分辨率与患者的心率无关。这是与单源CT系统的一个主要区别,单源CT系统可以通过在多扇区重建中将多个心动周期的数据组合成一幅图像来提供类似的时间分辨率。在多扇区重建中,时间分辨率强烈依赖于心率和机架旋转时间的关系,存在时间分辨率“最佳点”,在某些心率情况下其时间分辨率不能超过机架旋转时间的一半。同时,DSCT在高心率和不规则心率患者中可靠执行CCTA的潜力已得到证实,并且已经证明,DSCT足够准确,可以诊断部分或所有难以成像的患者中具有临床意义的冠状动脉疾病。图14显示了使用第三代DSCT进行冠状动脉CTA检查的临床示例,需要相对较长的22厘米扫描范围,因为患者有冠状动脉搭桥。 图13 具有两个独立测量系统的DSCT:(a)第一代,系统角度为90度;(b)第二代,为了将探测器B的SFOV增加到33厘米,选择了95度的较大系统角度。第三代DSCT(c),探测器B的SFOV进一步增加至35.5 cm。DSCT实现的时间分辨率约为机架旋转时间的四分之一。每个测量系统仅获取约90度的扫描数据,两个数据段都附加到靠近等中心的图像重建所需的半扫描中。DSCT提供时间分辨率远低于100 ms的图像。例如,具有0.25 s机架旋转时间的第三代DSCT可实现66 ms的时间分辨率。时间分辨率与患者的心率无关。这是与单源CT系统的一个主要区别,单源CT系统可以通过在多扇区重建中将多个心动周期的数据组合成一幅图像来提供类似的时间分辨率。在多扇区重建中,时间分辨率强烈依赖于心率和机架旋转时间的关系,存在时间分辨率“最佳点”,在某些心率情况下其时间分辨率不能超过机架旋转时间的一半。同时,DSCT在高心率和不规则心率患者中可靠执行CCTA的潜力已得到证实,并且已经证明,DSCT足够准确,可以诊断部分或所有难以成像的患者中具有临床意义的冠状动脉疾病。图14显示了使用第三代DSCT进行冠状动脉CTA检查的临床示例,需要相对较长的22厘米扫描范围,因为患者有冠状动脉搭桥。 图14 在第三代DSCT上获得的搭桥和心率不稳定的房颤患者的CCTA图像。ECG触发序列扫描,扫描范围为21.9 cm。(a),(b)3D容积渲染图像(VRT)和(c)CPR。箭头所示为支架。DSCT系统提供了一种在一次心跳内扫描整个心脏的替代方法。对于单源CT,螺距p不能高于1.5,以确保沿z轴的无间隙容积覆盖。否则,采样间隙将导致过多的图像伪影。然而,对于DSCT,使用第二套探测器系统获取的数据将这些间隙填充至3.2的螺距。这对应于第三代DSCT的扫描速度为737mm/s(57.6 mm探测器覆宽度和0.25 s机架旋转时间)。大螺距扫描模式可与ECG触发相结合(见图15)。然后整个心脏(12厘米)在
约160毫秒内
被覆盖
,每幅图像的时间分辨率为66毫秒。
相邻z位置图像的扫描数据是在同一个心动周期内,在稍有不同的心脏时相获得。
在几项研究中已经证明,在心率足够低且稳定的患者中成功地使用了CCTA大螺距扫描技术,有可能在低辐射剂量下一次心跳扫描整个心脏。 图14 在第三代DSCT上获得的搭桥和心率不稳定的房颤患者的CCTA图像。ECG触发序列扫描,扫描范围为21.9 cm。(a),(b)3D容积渲染图像(VRT)和(c)CPR。箭头所示为支架。DSCT系统提供了一种在一次心跳内扫描整个心脏的替代方法。对于单源CT,螺距p不能高于1.5,以确保沿z轴的无间隙容积覆盖。否则,采样间隙将导致过多的图像伪影。然而,对于DSCT,使用第二套探测器系统获取的数据将这些间隙填充至3.2的螺距。这对应于第三代DSCT的扫描速度为737mm/s(57.6 mm探测器覆宽度和0.25 s机架旋转时间)。大螺距扫描模式可与ECG触发相结合(见图15)。然后整个心脏(12厘米)在
约160毫秒内
被覆盖
,每幅图像的时间分辨率为66毫秒。
相邻z位置图像的扫描数据是在同一个心动周期内,在稍有不同的心脏时相获得。
在几项研究中已经证明,在心率足够低且稳定的患者中成功地使用了CCTA大螺距扫描技术,有可能在低辐射剂量下一次心跳扫描整个心脏。 图15 心电触发DSCT大螺距扫描的原理。相邻z轴位置图像的扫描数据是在同一个心动周期内,在稍有不同的心脏时相获得的。大螺距扫描模式有利于在极短的扫描时间内检查更大的解剖范围,例如高时间分辨率的胸部CTA和快速主动脉CTA扫描。当然,由于X射线管功率的限制,用大螺距技术对肥胖患者进行检查可能具有挑战性。高扫描速度和相应的短扫描时间也有助于儿科放射学。ECG触发的大螺距扫描已用于急诊室的全面胸部检查以及TAVR的规划和/或检查,因为它们在低辐射剂量下的一次扫描中提供了冠状动脉、主动脉和髂动脉的充分可视化(见图16)。非常短的总扫描时间可以减少注射的对比剂量。 图15 心电触发DSCT大螺距扫描的原理。相邻z轴位置图像的扫描数据是在同一个心动周期内,在稍有不同的心脏时相获得的。大螺距扫描模式有利于在极短的扫描时间内检查更大的解剖范围,例如高时间分辨率的胸部CTA和快速主动脉CTA扫描。当然,由于X射线管功率的限制,用大螺距技术对肥胖患者进行检查可能具有挑战性。高扫描速度和相应的短扫描时间也有助于儿科放射学。ECG触发的大螺距扫描已用于急诊室的全面胸部检查以及TAVR的规划和/或检查,因为它们在低辐射剂量下的一次扫描中提供了冠状动脉、主动脉和髂动脉的充分可视化(见图16)。非常短的总扫描时间可以减少注射的对比剂量。 图16 紧急情况下ECG触发的主动脉大螺距螺旋扫描:主动脉夹层伴左肾动脉受累;使用第三代DSCT以3.2螺距采集,总扫描时间0.8秒,90 kV,CTDIvol=2.81mGy,DLP=178 mGycm。使用DSCT,可通过在不同kV设置(例如80和140 kV)下同时操作两个X射线管来获取双能量数据。通过对高kV光束进行额外的预过滤,可以改善光谱分离,目的是通过锡过滤器在降低辐射剂量的情况下实现更好的材料量化,锡过滤器可在需要时移入光束,并在非DE应用中移出。尽管DSCT系统具有临床优势,但仍需要应对许多挑战。图像重建的一个主要挑战是数据截断:对于紧凑的机架设计,一个探测器A覆盖整个SFOV(Ø50cm),而另一个探测器B仅限于较小的中心视野(FOV)(见图13)。因此,如果扫描对象超出中心FOV,检测器B的投影数据将被截断,并且需要对数据进行外推以避免图像中的截断伪影。使用探测器A获取的数据用于推断探测器B的截断投影。另一个挑战是交叉散射辐射,即探测器A检测到的X射线管B的散射辐射,反之亦然。交叉散射辐射会造成伪影,降低图像的对比度和噪声比。在双能量扫描中,它可能导致不正确的材料分解和材料分类。交叉散射需要足够的校正。最直接的校正方法是直接测量探测器A和B中的交叉散射辐射,并从测量信号中减去。该技术需要在直射光束外的每个探测器上安装额外的探测器元件,并在第二代DSCT中实现。直接测量的替代方法是基于模型的交叉散射校正。交叉散射辐射的主要来源是物体表面的康普顿散射,因此对物体表面的了解足以预测交叉散射。然而,通过分析原始数据正弦图的轮廓,可以很容易地确定物体表面。该技术已在第一代DSCT中实现。具有相似表面形状的物体的预存储交叉散射表用于交叉散射辐射的在线校正。基于测量和基于模型的交叉散射校正结果如图17所示。在第三代DSCT中,实施了基于交叉散射简化蒙特卡罗模拟的校正。 图16 紧急情况下ECG触发的主动脉大螺距螺旋扫描:主动脉夹层伴左肾动脉受累;使用第三代DSCT以3.2螺距采集,总扫描时间0.8秒,90 kV,CTDIvol=2.81mGy,DLP=178 mGycm。使用DSCT,可通过在不同kV设置(例如80和140 kV)下同时操作两个X射线管来获取双能量数据。通过对高kV光束进行额外的预过滤,可以改善光谱分离,目的是通过锡过滤器在降低辐射剂量的情况下实现更好的材料量化,锡过滤器可在需要时移入光束,并在非DE应用中移出。尽管DSCT系统具有临床优势,但仍需要应对许多挑战。图像重建的一个主要挑战是数据截断:对于紧凑的机架设计,一个探测器A覆盖整个SFOV(Ø50cm),而另一个探测器B仅限于较小的中心视野(FOV)(见图13)。因此,如果扫描对象超出中心FOV,检测器B的投影数据将被截断,并且需要对数据进行外推以避免图像中的截断伪影。使用探测器A获取的数据用于推断探测器B的截断投影。另一个挑战是交叉散射辐射,即探测器A检测到的X射线管B的散射辐射,反之亦然。交叉散射辐射会造成伪影,降低图像的对比度和噪声比。在双能量扫描中,它可能导致不正确的材料分解和材料分类。交叉散射需要足够的校正。最直接的校正方法是直接测量探测器A和B中的交叉散射辐射,并从测量信号中减去。该技术需要在直射光束外的每个探测器上安装额外的探测器元件,并在第二代DSCT中实现。直接测量的替代方法是基于模型的交叉散射校正。交叉散射辐射的主要来源是物体表面的康普顿散射,因此对物体表面的了解足以预测交叉散射。然而,通过分析原始数据正弦图的轮廓,可以很容易地确定物体表面。该技术已在第一代DSCT中实现。具有相似表面形状的物体的预存储交叉散射表用于交叉散射辐射的在线校正。基于测量和基于模型的交叉散射校正结果如图17所示。在第三代DSCT中,实施了基于交叉散射简化蒙特卡罗模拟的校正。 图17 在DSCT系统上扫描带有心脏插入物的拟人胸部模型的图像。在等中心,z方向的x射线束宽为38.4 mm。视野420毫米,窗宽300 HU,窗中心40 HU(a) 无散射校正。箭头表示由于直接散射和交叉散射而产生的散射伪影(b) 基于测量的散射校正(c) 基于模型的散射校正。 图17 在DSCT系统上扫描带有心脏插入物的拟人胸部模型的图像。在等中心,z方向的x射线束宽为38.4 mm。视野420毫米,窗宽300 HU,窗中心40 HU(a) 无散射校正。箭头表示由于直接散射和交叉散射而产生的散射伪影(b) 基于测量的散射校正(c) 基于模型的散射校正。全文编译自:Hsieh J, Flohr T. Computed tomography recent history and future perspectives. J Med Imaging (Bellingham). 2021 Sep;8(5):052109. 文中观点均为原作者观点(本文作者系GE原首席科学家及西门子首席科学家),仅为专业人士交流目的,不用于商业用途。 2021年9月13日
|