【前沿】基于纹理分析的PET/CT图像特征研究:既往、现状…更好的未来? |
您所在的位置:网站首页 › ct图像的特征 › 【前沿】基于纹理分析的PET/CT图像特征研究:既往、现状…更好的未来? |
【前沿】基于纹理分析的PET/CT图像特征研究:既往、现状…更好的未来?
|
图像体素强度的异质性可通过不同的图像处理和分析方法来实现量化,包括纹理分析(TA) [3] 、分形分析 [13] 、形状模型 [14-16] 、强度直方图分析 [15,17] 以及结合基于统计频率的过滤方法 [18] 。本文侧重于TA在PET/ CT图像应用上,为完整起见,在补充材料第1中有一节专门讨论异质性指标选择。 从数据中系统地构建更高维度的信息属于‘组学’的一般范畴,包括基因组学、蛋白质组学和其他组学 [19] 。从图像中提取大量特征信息(包括TA指标、形状描述和其他定量指标)这种方式在影像组学领域很普及 [20,21] 。这种方法的潜在价值在于量化组织和/或器官指标,而这些指标不能用肉眼辨别或用简单的定量指标判断。自从20世纪90年代初 [22,23] (2千年代末)以来TA在磁共振和CT成像中的应用,现已广泛应用于PET肿瘤内异质性的表征 [15,24,25] 。由于信噪比和空间分辨率较低,以及空间采样较差,PET图像在TA特性方面并不比MRI或CT优越。此外,临床上常用滤波函数平滑重建PET图像,以便临床医生阅片判读,这降低了图像,如高斯滤波等纹理信息, [26] 。随着PET/CT的出现、飞行时间(TOF)能力提高、灵敏度的改进以及在临床黄金标准迭代重建算法中引入了几个定量校正,PET成像的保真度和定量准确度在过去十年中得到了显著改善[27]。应用中要注意PET / CT的低剂量CT所获得图像信息与更高分辨率或诊断CT的图像之间存在差异性。 过去4年已有许多PET/CT摄取异质性的研究论文发表,主要集中在PET组件上。对TA而言可惜的是因所需的预处理步骤数量以及所涉及工作流程中繁琐选择步骤,导致了相互矛盾的结果和并引起争议,也使得相关研究结果之间无可比性 [28] 。此外,在生物医学领域,阳性结果比阴性结果更容易发表文章的倾向 [29] 可能导致PET的TA方法潜在价值存在过于乐观评估。在当下普遍关注生物医学研究重复性的情景下,这也是需要认真对待 [30] 。 本综述的目的是对目前TA在PET/CT放射性示踪剂摄取异质性中的应用迅增提供批判性见解,并指出目前有待解决的问题和挑战。最后,对以后的研究方法和报告标准也做了一些探讨。 既往:临床机遇与潜在价值 临床实践和研究逐渐认识到PET的标准度量单位最大或平均标准摄取值(SUVmax和SUVmean)或代谢活性肿瘤体积(MATV)不能充分反应肿瘤的特征,而纹理分析潜在的临床价值使人们对它的认识逐渐提高 [14] 。纹理分析的一些特性如病变的形状和摄取的异质性,可反映不同的肿瘤特征,这些特征与肿瘤的侵袭性、转移潜能或对特定治疗的反应程度及疾病的预后有关 [31,32] 。纹理分析的量化特性比常规指标具有更高临床价值,可用于患者分期或识别治疗效果不佳的患者。 El Naqa及其同事在一项对9例头颈癌和14例宫颈癌患者研究中,首次报道应用TA概念评估PET图像 [15] 。然而在接下来的两年里,仅仅有两项关于PET纹理分析的研究被发表。第一项研究项目指出PET图像迭代重建算法参数对纹理分析(TA)指标有影响,指出不同的图像重建方法容易导致许多纹理指标的变化 [24] 。如果这些纹理特征准备应用于多中心研究,需要进行图像重建方法的标准化。其次,目前观察到一些纹理特征的变异性>100%,即使在用一个检查设备进行的研究也会有较大的变异,这些特征会导致纹理分析(TA)的使用价值不大。第二项研究调查了41例接受联合化疗的局部晚期食管癌患者使用纹理分析(TA)量化FDG摄取异质性的预测价值,结果表明TA指标比SUV具有更高的预测价值 [25] 。 随后的几项研究表明定量指标(包括累积柱状图曲线下的面积、形态描述(见第1节补充材料)和纹理分析TA)和PET图像肿瘤异质性的专家视觉评估之间存在显著相关性。然而,PET图像摄取异质性可解释肿瘤潜在生物学意义,以及解释TA为什么比常用的标准度量指标更能区分肿瘤潜在代谢、细胞增殖、缺氧和坏死等。但这些特征都依赖使用的放射性示踪剂。到目前为止,大多数研究都是用FDG(和静态SUV图像)进行图像分析的,只有少数研究使用其他放射性药物如FET、FLT和DBTZ[16]。 与CT或MRI比较,有几项研究显示TA图像特征与肿瘤的病理生理学特征(包括基因组学水平)、疾病的变化和临床价值具有关联性,从而为它们的相关性和潜在临床价值提供了越来越多的证据。据我们所知,目前关于TA在PET上的类似研究不多。一项在HI/TV期结直肠癌中发现FDG PET纹理分析(TA)与CT的灌注参数(如血流)具有相关性 [41] 。近期一项对54例头颈癌患者进行前瞻性研究发现PET 纹理分析(TA)指标可能与细胞信号传导途径改变有关,如细胞增殖和凋亡 [42] 。较多的研究表明与标准定量参数相比,PET 纹理分析(TA)具有更高的临床价值。 现状:快速发展期 几十项研究分析了不同肿瘤类型(包括:食管、肺、直肠、乳腺、头颈部和颅脑的肿瘤,淋巴瘤)PET摄取异质性(应用TA或其他方法)在临床中的价值,仅在过去4年内已有文献报道了神经退行性疾病在PET[16,43]及DAT SPECT[44]摄取上同样存在异质性。最近,一些研究也聚焦在同从PET和CT表现中提炼其他更有意义的影像特点(见下文关于有希望取得临床结果的一节)。对于更详尽的列表,我们向读者推荐其他最近的文献综述评价[2–4, 9, 45–49]。从这些研究的批判性文献综述中,我们可以发现几个常见的问题。 术语可变性、公式和实施问题 TA指标和命名定义的可变性以及方法、发布的公式和计算代码中的错误,使对该结果的任何评估和比较都变得复杂。术语“纹理”一词的使用本身可能会令人困惑。在最近的一项研究中,标题和摘要都提到了“纹理参数”,报告了27名直肠癌患者的队列研究中对治疗反应的较高预测值[50]。然而,只探讨了一阶直方图导出的特征(变异系数、偏度和峰度),而没有探讨二阶或高阶特征的纹理特征(这些特征实际上考虑到空间分布)。此外,对这些指标在治疗前、治疗中和治疗后获得的PET图像中进行了比较,其可重复性需要仔细验证。先前的研究表明,这些特征的重复性相对较低,特别是偏度[51,52]。因为最近一项关于DCEMRI在肺癌应用中的研究使用了完全相同的术语“纹理”,尽管只使用了一阶直方图衍生的度量标准[12],说明该术语重复性的挑战并不局限于PET研究。潜在命名混乱的另一个例子是使用术语“熵”来表示一阶度量的“随机性”或“无序”,而实际上它是概率直方图的熵[12]。此外,我们建议使用术语“熵 GLCM ”和“熵 HIST ”,以避免在共生矩阵和直方图中计算的特征之间的混淆,因为对熵的直观理解可能不适用于这些度量。同样,我们建议使用术语“对比 GLCM ”和“对比 NGTDM ”,以避免混淆。 补充材料3包含计算TA指标的公式列表,并附有详细注释。还提供了几个软件[53,54],但需要确保所有特征计算在可靠地用于研究之前都能够得到准确的实现。补充材料4包含若干此类代码的列表以及相关说明。 工作流程的复杂性 TA的一个问题是在理论上可计算出超量的参数,有些报道超过100个参数,以及它们可以计算方式的数量。在标准指标(SUV,MATV)量化中,诸如采集方案、扫描仪类型、定量校正、重建算法和参数的类型、图像后处理、感兴趣区域定义等公认的可变性源也可能对TA特征产生相似的影响。除此之外,还存在另外的对TA指标具有相似的(若非更高的)影响的额外步骤和方法选择。图1说明了TA工作流程的复杂性,下面的部分讨论了不同的步骤。要注意除某些上游步骤外,诸如分割(参见下文PET肿瘤体积分割部分)等还可能影响这些选择。
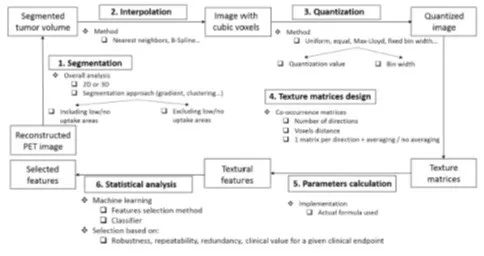
图1. 从重建的PET图像中计算和选择纹理分析的工作流程 一阶特征可评估单个体素值的特性,而忽略它们之间的空间相互作用(因此不能被视为“纹理”特征,因为它们不区分空间排列和模式),而二阶和高阶特征评估在相对于彼此的特定位置出现的两个或更多个体素值的性质。对于这些二阶和高阶TA特征,第一步通常包括将非立方体素网格重采样或插值为立方体素(很少执行),并对原始强度(或SUV)执行量化(系统地执行,也称为离散化、降采样或重采样)为一组离散值。此数值决定了构建的矩阵大小,以及随后计算TA指标的大小。已有几种方法来执行这种量化(见补充部分2),例如线性分布到设置数量箱中(例如32或64)[15,25]、使用聚类算法(max-Lloyd)[55]或进入固定宽度箱中(例如0.25 SUV[52]或0.5SUV[56,57])。选择量化方法和数值可对TA结果的度量及其与肿瘤体积或SUVmax[51,56,58-60]的关系产生重要影响,因此,如图2所示,这是一个不容忽视的重要因素。
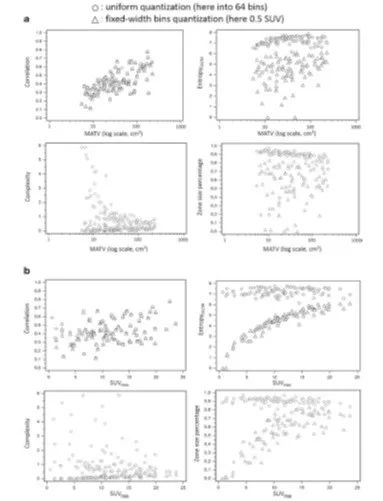
图2.关于(A)MATV和(B)四个TA特征的SUVmax分布(GLCM的相关性和EnropyGLCM,NGTDM的复杂度和GLZSM的区域大小百分比),量化后得到一个固定数量箤(这里是64)或固定宽度的箤(这里为0.5 SUV)。请注意,与其他三种指标相比,相关性不受影响。另外,当改变量化方法时,请注意与MATV和SUVmax之间的负相关关系。 第二步是构造纹理矩阵,其中有几个矩阵(如灰度共生矩阵,GLCM;邻域灰度变异矩阵,NGTDM和灰度区域大小矩阵,GLZSM)可以不同的方式构建(参见补充材料,第3节)。如共生矩阵对体素对之间的关系进行量化,它们通常根据给定的空间方向和一对体素之间的给定距离来定义。对于3D分析,常常考虑13个方向,并且每个方向都建立一个矩阵。然后计算这些矩阵中的每一个TA指标,并且对所得到的13个值进行平均。通常,距离被设置为一个体素。修改这些选择(如只对所有方向使用一个矩阵)可以产生与其他指标相关的、互补的、具有总体临床价值的不同的TA特征分布(参见图)。(3) [55,60]。 PET肿瘤体积分割 许多研究使用了最不完善和/或不准确的方法来定义整体肿瘤体积,如手动勾画或固定阈值。单一阅片者手动勾画可出现高概率的观察者之间和观察者本身的变异性,而固定阈值,是由最高摄取阈值确定肿瘤体积的范围,明显低估了真正的MATV[61,62]。这反过来又会使异质性评估和肿瘤内异质性水平产生偏差。另一个关注肿瘤体积的问题是在分析中优先考虑这个问题。更具体地说,我们可以定义功能体积,使得低或没有放射性示踪剂摄取的区域包括在体积中,或可选择性地从中剔除。将这些区域排除会把坏死区域排除在外,但也会在异质性分析中限制包括非病理区域的风险。所使用的分割方法的选择可能导致更多或更少的约束。例如,使用基于梯度的工具[63,64],得到的轮廓仅为二元的,覆盖整个肿瘤包括没有摄取的区域(图4)。相反,使用基于区域扩展或聚类模式的方法[65,66],通常会排除具有与背景摄取相似的摄取区域,尽管可以通过其他方法包括它们在分析当中。
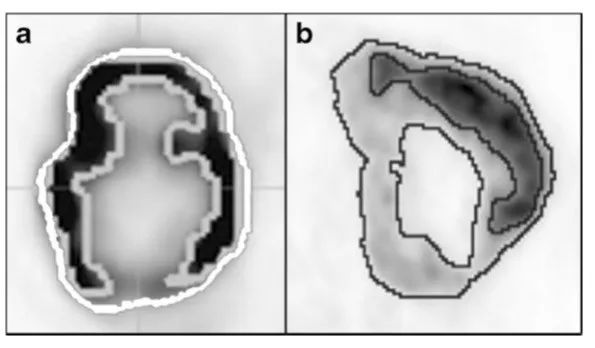
图4.折中的分割结果,使用(a)基于轮廓的方法(使用MIMVista软件的PET边界,白色为外部轮廓)或(b)基于聚类的方法(FLAB算法,黑色轮廓)。在浅灰色轮廓内,肿瘤对应于一个固定的阈值。在b中,对不同摄取水平的各个区域进行自动确定,并以更高的复杂性为代价,他们可能在异质性分析中被包含或排除。 统计问题 在绝大多数已发表的研究中,都没有进行包含潜在复杂因素的多变量分析,也没有对多种检查结果进行校正,也很少使用交叉测试的稳健机器学习。一般来说,检测患者数量相对于研究的参数和测试假设的数量来说是非常小的。理想情况下,这些研究应该结合在一个meta分析中,但是由于不断有新的结果报道[21],这样的meta分析实际上是不可行的。最后,因为研究群体在不同时期或治疗方式上的差异性,在实质上这类研究通常是回顾性,结果几乎从未在外部群体中得到验证。最近对15项研究(包括PET和CT)的回顾强调了这些问题,并表明大多数研究至少存在其中一些缺陷。该综述的结论是,从CT或PET图像中提取的TA指标的临床价值仍有待于证明[28]。 虽然在生物医学领域发表积极成果的倾向很强烈[29], 整体趋势基本上也是正面的,但我们必须明白,少数的研究已经得出这样的结论:异质性量化并没有带来任何有价值的临床意义[67–69]。更具体地说,在宫颈癌的两项研究中,一项“体积与阈值曲线”的指标无法预测73名患者的预后的结论[67],与之前在同一队列中的评估结果是相互矛盾的[70]。虽然标准偏差、偏度和峰度等其他一阶特征也包括在内,但需要强调的是,本研究从本质上强调了一个事实,即基于“体积对阈值曲线”的指标是体积指标的替代,而不是反应异质性的指标(参见补充资料)。同一作者进一步探索了另一组85例FIGO(国际妇产联盟)分期为IIb期癌症患者的附加指标(球形度、范围、Shannon熵和与最平滑梯度的累积偏差,即不包括TA指标),在预测盆腔淋巴结受累方面也有类似的阴性结论[69]。最后,在结果互相矛盾的这两个研究中,同一组报道了另一项研究的结果,指示TA指标可以从基线到第2周、第4周和治疗后PET扫描的时间演变,TA指标对20位宫颈癌患者治疗反应具有预测价值 [71]。还应该指出的是,在所有这些研究中,MATV都是使用SUVmax的40%的固定阈值来计算的。 一项最新的乳腺癌研究显示,在171名女性的前瞻性同质队列研究,与以前一个更小的组(n = 54) 的研究结果相反[72],考虑过去PET图像 TA指标中,在鉴别三种主要分子亚型的乳腺肿瘤方面,没有一项优于标准的临床因素和SUV指标 [68]。 (待续) 核医学医师分会科普与信息委员会科普与翻译小组 本期由翻译组以下委员翻译: 沈晨天:上海市第六人民医院、住院医师、博士 唐毅:桂林医学院第二附属医院核医学科主任,副主任医师 饶茂华:重庆医科大学附属第二医院核医学科,中级、硕士 白侠:内蒙古医科大学附属医院核医学科、副主任医师、硕士 赵敏:中南大学湘雅医院核医学科、副主任医师、博士 张茜:山西省肿瘤医院核医学科、副主任医师、博士 靳会宾:河南省人民医院核医学科、主治医师、硕士 江苏大学附属宜兴医院吉爱兵教授校稿,北京友谊医院李春林教授终审。 校稿专家简介
吉爱兵 主任医师,江苏大学附属宜兴医院核医学科主任 中国医师协会核医学医师分会科信委科普与翻译组副组长 中华核医学分会分子影像人工智能工作委员会副主任委员 中华医学会核医学分会显像学组委员 江苏省毒理学学会放射毒理分会委员 江苏省医学会核医学分会功能显像学组委员 无锡市医学会核医学分会副主任委员 《中国医学装备》杂志第四届编委会编委 专注于核医学影像AI数据分析及核素治疗,在中华级及核心期刊发表学术论文多篇。返回搜狐,查看更多 |
【本文地址】