北京大学雷晓光课题组:“后期多样化衍生策略”在天然产物合成与创新药物研发中的应用 |
您所在的位置:网站首页 › ch3ch2och2ch3官能团名称 › 北京大学雷晓光课题组:“后期多样化衍生策略”在天然产物合成与创新药物研发中的应用 |
北京大学雷晓光课题组:“后期多样化衍生策略”在天然产物合成与创新药物研发中的应用
|
北京大学雷晓光课题组:“后期多样化衍生策略”在天然产物合成与创新药物研发中的应用
活性天然产物一直在合成化学发展、生物医学研究、与创新药物发现中扮演着重要角色。过去三十年中,接近50%的新上市的创新药物来源于天然产物或其衍生物。天然产物的衍生化对构效关系研究和药物活性优化至关重要。而直接通过选择性的官能团化对天然产物进行后期衍生改造无疑是最经济高效的方法。此外,对于天然产物的后期衍生化也可以帮助快速、有效地构造出化学探针,帮助开展化学生物学研究,揭示新的生物靶点和作用机制。
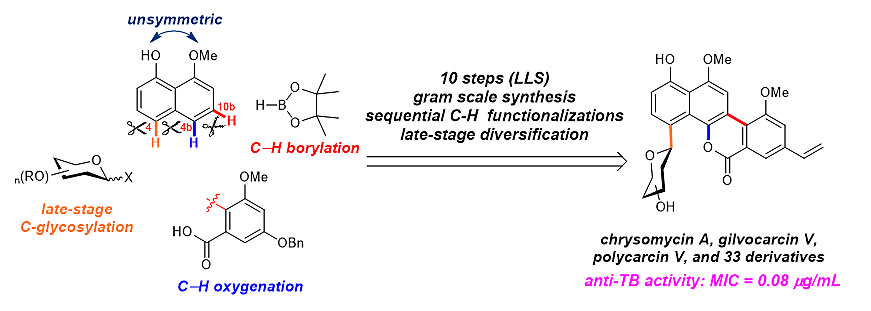
图1. 来源于天然产物的明星药物分子 近年来,随着有机合成方法学与生物酶催化技术的蓬勃发展,涌现出很多在复杂底物上进行选择性官能团化的方法,这些方法极大地促进了天然产物“后期多样化衍生策略(late-stage diversification)”的发展。基于在天然产物后期多样化衍生方面的出色工作,近期北京大学化学与分子工程学院雷晓光教授课题组在美国化学会旗舰期刊ACS Central Science 期刊上发表了两篇背靠背文章,详细阐述了“后期多样化衍生策略”在天然产物合成与创新药物研发中的应用。 在第一篇研究论文中[1],雷晓光课题组首先利用有效的“连续碳-氢键活化策略(sequential C-H functionalizations)”实现了一类结构新颖、独特的碳-芳基糖苷类天然产物chrysomycin A、polycarcin V和gilvocarcin V的高效全合成(图2)。整个合成路线简洁、高效,只利用了10步化学转化就实现了三个复杂天然产物分子的“克级”全合成,比起之前其他课题组所报道的合成路线(18-30步),在合成效率上有了非常大的提高。
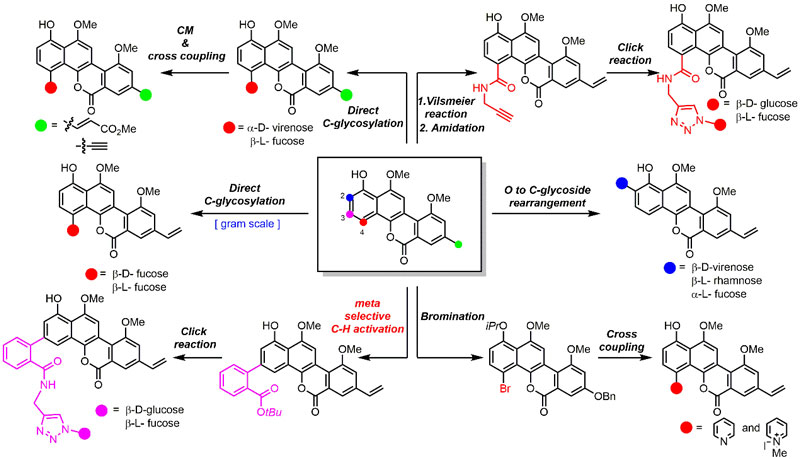
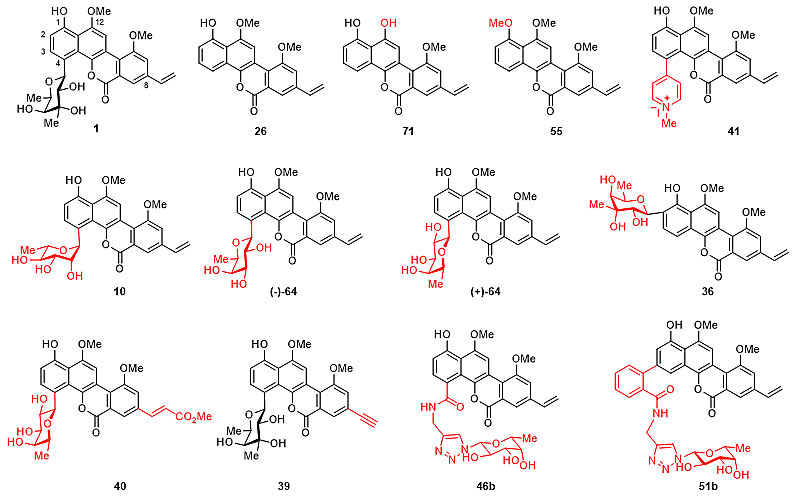
图2. 天然产物chrysomycin A、polycarcin V和gilvocarcin V的高效全合成 在全合成基础之上,雷晓光课题组进一步利用“后期多样化衍生策略”,对天然产物进行了大量的结构优化、改造。利用多种不同的直接官能团化合成方法,包括美国Scripps研究所余金权教授课题组所开发出的“间位选择性碳-氢键活化策略”( J. Am. Chem. Soc., 2016, 138, 9269),成功地制备了33个结构新颖的天然产物衍生物(图3)。通过进一步与华东理工大学的张立新教授课题组合作,研究者发现该类天然产物及其衍生物具有很好的抗结核杆菌的活性。
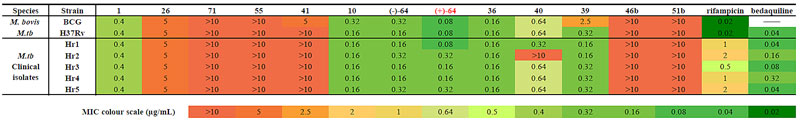
图3. 利用天然产物“后期多样化衍生策略”制备多个天然产物衍生物 肺结核病已经成为目前全球每年致死人数排名第一的传染性疾病,每年会导致大约1000万人的新增感染病例以及180万人的死亡病例。此外,多药耐药性和极端耐药性结核杆菌的出现,为结核病的治疗带来了更加严峻的挑战。在过去的40年中,只有两个治疗多药耐药性结核病的创新药物被开发出来。但是,考虑到临床试验的高消耗率,开发更为有效、且具有新的生物作用机制的抗结核药物,以克服目前广泛产生的耐药性是全球的迫切需求。 在此研究中,雷晓光课题组与合作者发现天然产物chrysomycin A(1)对于野生型和多个临床分离的多药耐药结核杆菌细胞株都具有良好的抑制活性(MIC = 0.4 μg/mL)。进一步对新合成的、结构新颖的天然产物衍生物的活性测试发现,衍生物(+)-64的活性比起原始天然产物有5倍的提高(MIC = 0.08 μg/mL)。令人兴奋的是,该类天然产物和衍生物在不同细胞株上都没有展示出明显的耐药性,暗示着这类天然产物很有可能是具有全新的生物作用机制(图4)。目前,雷晓光课题组正在进一步开展后继的化学生物学研究,希望可以发现该类天然产物的生物靶点并详细阐明抗菌的分子机制。同时,雷晓光课题组也在积极地推进基于该类天然产物的后期创新药物开发。
图4. 发现多个抗耐药结核杆菌的候选药物分子 在该文章中,雷晓光课题组博士生吴凡和已经毕业的张静博士,以及中科院微生物所的宋福行研究员为文章共同第一作者,雷晓光教授为通讯作者。此外,华东理工大学的张立新教授科研团队,美国Scripps研究所的余金权教授,以及雷晓光课题组博士生王三山也为该工作做出了重要贡献。该工作主要得到科技部重点研发计划、国家自然科学基金、北京市卓越青年科学家项目,以及北大清华生命科学联合研究中心的资助。 在第二篇展望型综述(Outlook)中 [2],雷晓光课题组应邀撰写文章,详细总结了天然产物后期多样化衍生的发展历史并同时展望了未来的应用前景。该综述强调该策略在合成方法学的发展、药物先导化合物的优化、生物靶标的鉴定、蛋白-蛋白相互作用的调控、以及天然产物生物合成途径探索等方面的重要作用。
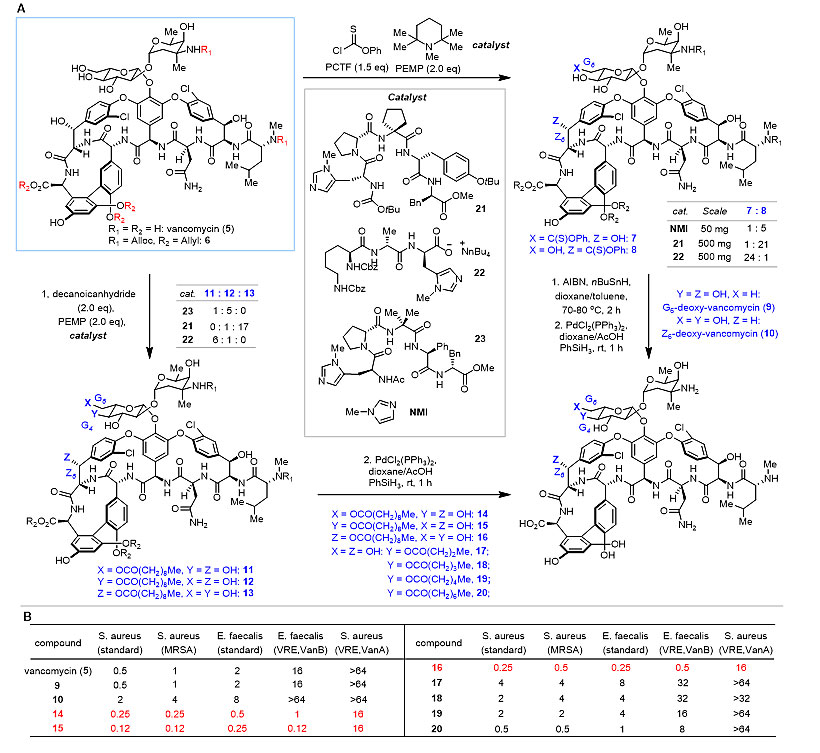
图5. 不同合成方法在天然产物后期多样化衍生中的应用 合成方法学的发展 天然产物通常具有复杂的环系骨架和多样的活性基团。很多的天然产物中存在多个相同的活性基团,例如多醇类,多烯类和多苯环类天然产物。对这类天然产物进行衍生化通常需要使用保护基,而随着选择性官能团化反应的发展 (Angew. Chem., Int. Ed., 2012, 51, 10954-10990; Top. Curr. Chem., 2015, 372, 157-202),选择性地对某一特定的活性基团进行官能团化为合成这类天然产物的衍生物的提供了更高效方法。以万古霉素(vancomycin)为例,Scott Miller课题组通过使用不同的多肽催化剂可以对Z6、G4 和G6 三个位置的羟基进行选择性的官能团化(J. Am. Chem. Soc., 2012, 134, 9755-9761; J. Med. Chem., 2015, 58, 2367-2377),最终高效地得到一系列万古霉素衍生物,其中包括对耐药菌具有更好活性的脂化衍生物(图6)。
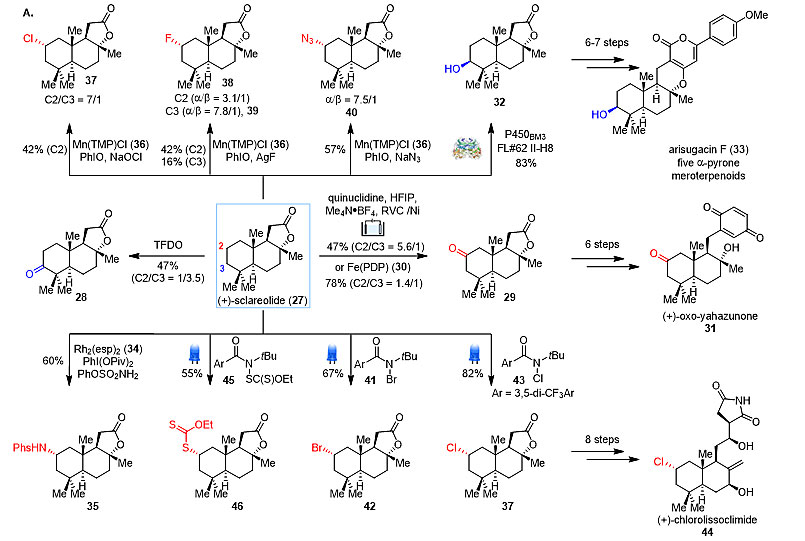
图6. 万古霉素的后期衍生化 除了多样的活性基团外,惰性的碳-氢键更是广泛存与天然产物中。碳-氢活化(J. Am. Chem. Soc., 2016, 138, 2-24)、光化学(Chem. Rev., 2013, 113, 5322-5363)、电化学(ACS Cent. Sci., 2016, 2, 302-308)和生物催化(Chem. Soc. Rev., 2011, 40, 2003-2021)等领域的巨大发展使得复杂天然产物中碳-氢键的直接官能团化成为可能。以香紫苏内酯为例,在不同的催化剂和反应条件下,可以获得不同的衍生化产物(图7)。
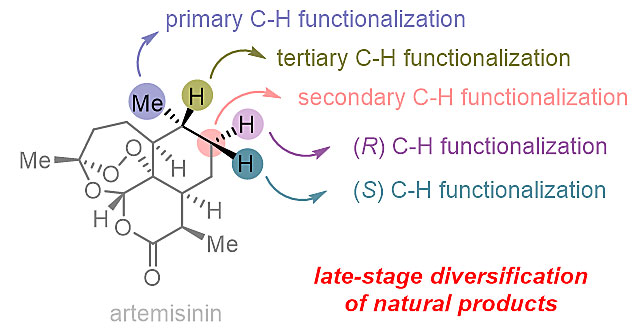
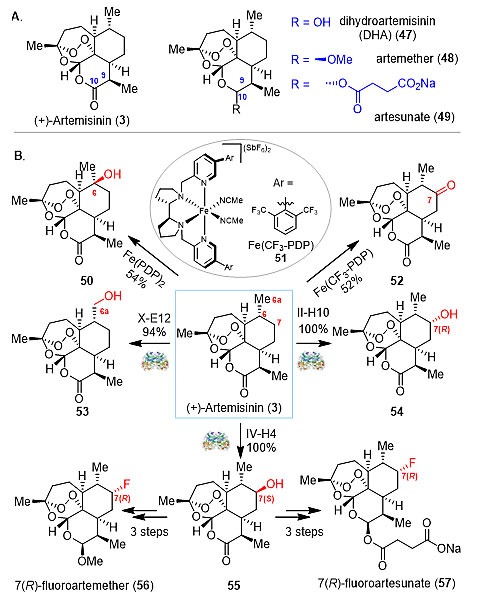
图7. 香紫苏内酯的后期衍生化 药物先导化合物的改造 在药物开发中,需要合成先导化合物衍生物来优化先导化合物的生物活性和药理性质。而选择性碳-氢键官能团化反应可以让我们直接对先导化合物进行修饰,从而合成出传统方法无法获得的衍生物,这为新的药物或活性先导化合物的发现提供了新的可能性。 青蒿素类(Artemisinin)药物被WHO推荐为治疗疟疾的首选药物。但其在体内的半衰期过短导致生物利用度不高,经常需要与其他的长效的抗疟药物联用。所以需要新的青蒿素衍生物去解决上述的药理局限性以及越来越严峻的抗药性。而对青蒿素的结构改造主要是对其活性内酯环的衍生上,如二氢青蒿素、青蒿素甲醚和青蒿琥酯。由于青蒿素骨架结构缺少活性基团,在其他位点的修饰异常困难。White 课题组发展出一类Fe催化剂,可以选择性的实现C6和C7位的碳-氢键氧化(Science, 2007, 318, 783-787; J. Am. Chem. Soc., 2013, 135, 14052-14055)。Fasan 课题组对P450BM3氧化酶进行定点进化,实现了对C6a、C7(R)和C7(S) 三个位置碳-氢键的选择性羟化(J. Am. Chem. Soc., 2012, 134, 18695-18704)。在这个基础上,Fasan 课题组制备了7(R)位氟代的青蒿素甲醚和青蒿琥酯,7(R)位C-F键可能会减缓或阻止青蒿素在体内的C7位一级代谢,因此延长半衰期提高生物利用度(图8)。
图8. 青蒿素的后期衍生化 截短侧耳素(pleuromutilin)及其衍生物是一类抗菌药物,主要作用于革兰氏阳性菌。研究发现,其12位异构化的衍生物对耐药菌和革兰氏阴性菌具有良好的活性。为了应对越来越严峻的抗生素耐药性和革兰氏阴性菌的治疗问题,基于截短侧耳素的衍生物合成一直是研究的热点。而对截短侧耳素的衍生主要集中在22位的活性羟基上,如上市药物retapamulin和lefamulin。由于截短侧耳素的骨架结构中缺少活性基团,对其骨架结构进行修饰异常困难。Herzon课题组以14位和17位的羟基作为导向基团,利用Hartwig 碳-氢硅化/氧化反应首次实现了对三元环骨架上16位、17位、18位、15位的衍生,为新的构效关系的研究和活性分子的发现提供了可能(J. Org. Chem., 2018, 83, 6843-6892, 图9)。
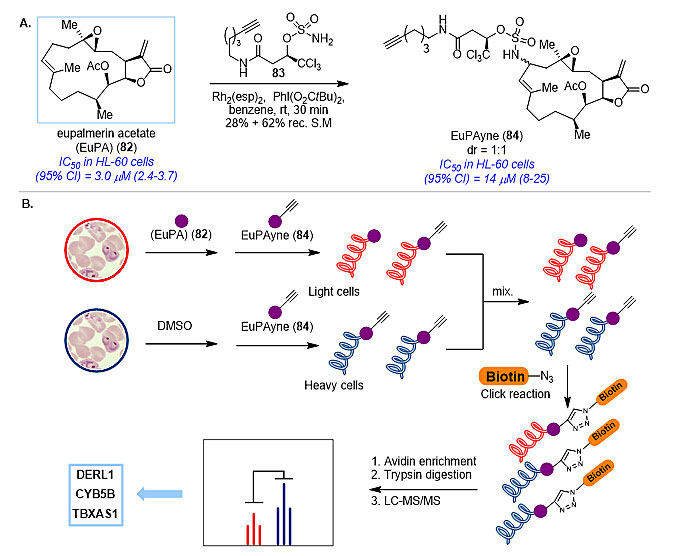
图9. 截短侧耳素的后期衍生化 生物靶标的鉴定 在药物的开发过程中,确定活性天然产物分子的作用靶点和作用机制至关重要。生物靶标的鉴定往往需要基于天然产物的活性化学探针。传统的化学探针的制备方法需要依赖于天然产物中已有的活性基团,而这些活性基团往往与生物活性方有关。碳-氢活化的发展为基于天然产物,特别是缺少活性官能团的天然产物的化学探针的制备提供了新的可能。 西松烷型二萜Eupalmerin acetate (EuPA)具有良好的抗肿瘤活性,但作用靶点未知。Eupalmerin acetate结构中的活性官能团有限,这使得活性化学探针分子的制备非常有挑战。为了不影响在生物活性中可能起重要作用的enone 结构,Romo课题组利用C-H胺化反应选择性地在远离enone 结构的大环上连上报告基团,获得探针分子EuPAyne(Nat. Chem., 2013, 5, 510−517)。EuPAyne可保持和EuPA相当的生物活性,随后凝胶蛋白质组学分析和竞争性ABPPSILAC定量蛋白质组分析鉴定出三个靶标蛋白:肿瘤细胞增殖相关蛋白DERL1,癌细胞过表达的细胞色素CYB5B和血栓素合成酶A(TBXAS1)。这表明EuPA抗肿瘤活性具有多种作用机制(图10)。
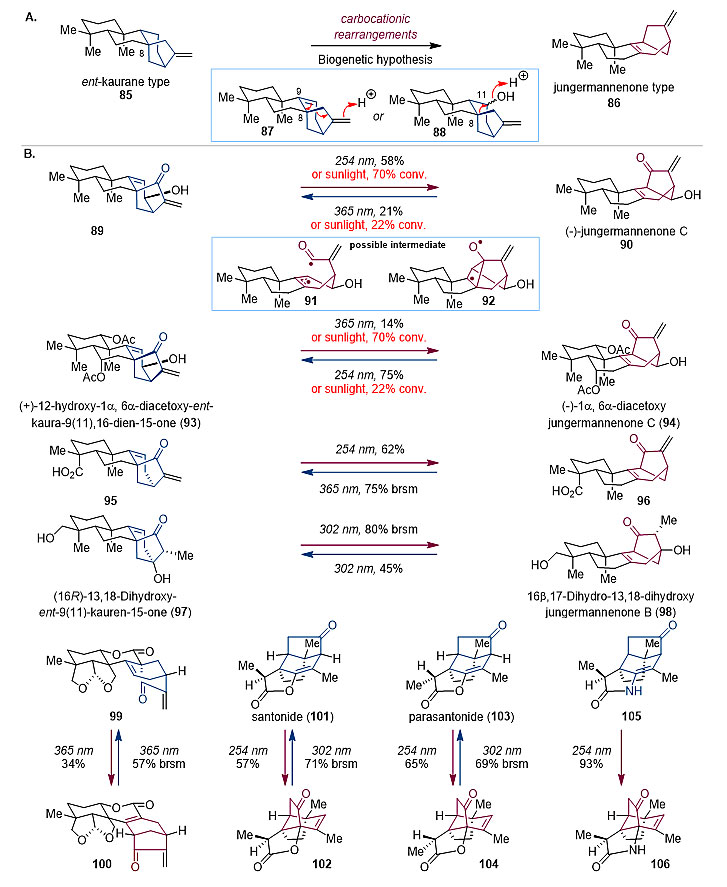
图10. 通过后期衍生制备EuPA的活性化学探针 生物合成途径修正 天然产物生源合成途径中的关键转化被合成化学家广泛应用于复杂分子的仿生合成中。仿生合成同时也有助于确认最初提出的生源假说,进一步阐明天然产物的生源合成途径。 香茶菜属(Isodon)二萜是一类结构复杂的多环活性天然产物,其生源合成是从GGPP 出发通过一系列酶促环化反应而来。最初的生源途径认为,jungermannenone 型二萜是从ent-kaurane 型二萜通过两种可能的碳正离子重排而来。雷晓光课题组在对香茶菜属二萜的合成研究过程中,发现基于生源假说的碳正离子重排无法实现ent-kaurane骨架到jungermannenone骨架的后期直接转化。最终通过紫外光引发的[3,2,1]桥环骨架重排实现了jungermannenone 型骨架产物 (-)-jungermannenone C和 ent-kaurane骨架产物的后期相互转化(Chem, 2019, 5, 1671-1681; Angew. Chem. Int. Ed.,2019, 58, 10879-10883)。该紫外光引发的[3,2,1]桥环骨架重排反应可能通过β,γ不饱和酮的1,3酰基迁移实现,其经过两种可能的自由基中间体。ent-kaurane骨架和jungermannenone 骨架的相互转化在太阳光下仍可顺利进行,这表明jungermannenone 型二萜和ent-kaurane 型二萜生源上可能通过光引发的自由基[3,2,1]桥环骨架重排相互转化而来,而非碳正离子重排。随后该后期的骨架重排反应被应用在一系列骨架多样的天然产物和类似物上,例如ent-kaurane型、jungermannenone型和6,7-seco-ent-kaurane型,表明其具有良好的适用性和官能团耐受性(图11)。
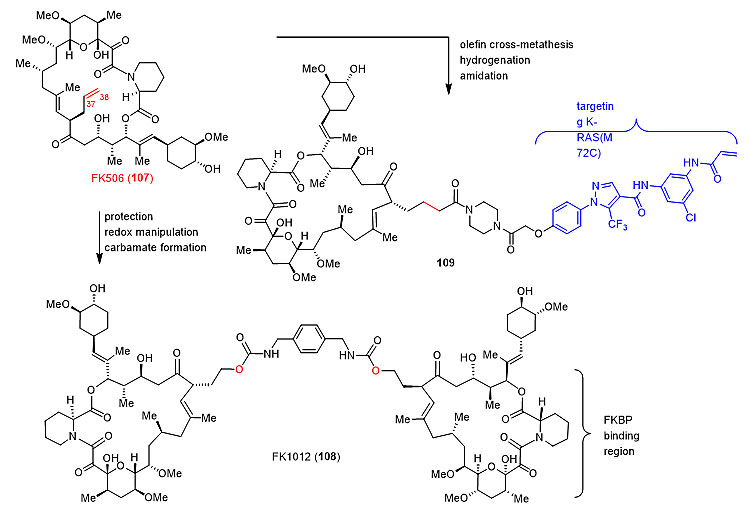
图11. 萜类天然产物的后期骨架重排 蛋白-蛋白相互作用 天然产物在调节蛋白质-蛋白质相互作用中具有重要作用。FK506是具有免疫抑制活性的大环内酯天然产物,其作用于亲免素FKBP和钙调神经磷酸酶(calcineurin)形成三元复合物。其作用机理的阐明不仅代表了化学生物学领域的一个里程碑式的发现,还引领了二聚化化学诱导剂(CIDs)的发展。对FK506的末端烯烃进行后期衍生,制备了一系列的衍生物FK1012,其中108失去了FK506对钙调神经磷酸酶(calcineurin)的抑制活性,同时保持了其对FKBP12的高亲和力。因此利用该分子,可以精确地以剂量依赖的和小分子受控的方式人工调节具有FKBP12域的融合蛋白的二聚化。最近,Shokat小组在FK506基础上开发了双功能分子109,其可将突变的致癌K-Ras蛋白聚集到细胞内丰富的FKBP12蛋白上,阐明了该策略有望被用来干扰Ras活性并阻断其下游的信号通路 (Angew. Chem. Int. Ed., 2019, 58, 16314-1631, 图12)。
图12. 通过 FK506的后期衍生来调节蛋白-蛋白相互作用 文章最后指出天然产物后期多样化衍生策略的广泛应用仍然受制于目前合成方法在选择性等方面所存在的问题,仍需要进一步的发展高选择性的化学方法和催化剂,其中选择性C-H键活化方法、光催化方法以及生物催化方法(biocatalysis)在这一领域具有巨大的发展前景。为了充分挖掘天然产物后期多样化衍生的应用价值,各个领域需加强合作。随着化学方法的丰富,天然产物后期多样化衍生的新机遇和新应用也将不断涌现。 在本文章中,雷晓光课题组毕业博士生洪本科博士为文章第一作者,雷晓光教授为通讯作者。北京大学罗佗平教授在文章撰写过程中给予了重要帮助。该工作也得到国家自然科学基金、科技部重点研发计划、北京市卓越青年科学家项目、以及北大-清华生命联合中心的资助。 1. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Chrysomycin A Derivatives for the Treatment of Multi-Drug-Resistant Tuberculosis Fan Wu, Jing Zhang, Fuhang Song, Sanshan Wang, Hui Guo, Qi Wei, Huanqin Dai, Xiangyin Chen, Xuekui Xia, Xueting Liu, Lixin Zhang, Jin-Quan Yu, Xiaoguang Lei* ACS Cent. Sci., 2020, DOI: 10.1021/acscentsci.0c00122 2. 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Late-Stage Diversification of Natural Products Benke Hong, Tuoping Luo, Xiaoguang Lei* ACS Cent. Sci., 2020, DOI: 10.1021/acscentsci.9b00916 导师介绍 雷晓光 https://www.x-mol.com/groups/lei_xiaoguang 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】