科学网 |
您所在的位置:网站首页 › ch2chchch2是什么杂化 › 科学网 |
科学网
|
关于碳原子与氮原子的杂化
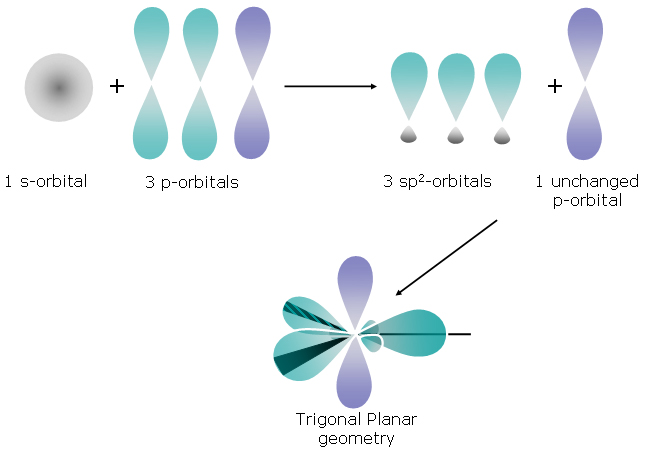
已有 19432 次阅读 2014-4-1 20:16 |系统分类:科研笔记| 杂化轨道, π键, σ鍵 首先借个图来理解杂化轨道
图片来自http://moodle.sgu.edu.cn/moodle/mod/page/view.php?id=6348&lang=en 关于碳原子的杂化: sp3杂化 参与杂化价电子的原子轨道:2s+2px+2py+2pz 所有4个价电子均参与杂化,形成4个新的简并轨道(sp3+sp3+sp3+sp3),每个轨道都用来形成一个σ鍵,键角109度。 例子:CH4 sp2杂化 参与杂化价电子的原子轨道:2s+2px+2py 4个轨道中的3个参与杂化,形成3个新的简并轨道(sp2+sp2+sp2+p),形成3个σ鍵,键角120度,剩余一个p轨道未参与杂化,用来形成π键。 例子:C2H4 sp杂化 参与杂化价电子的原子轨道:2s+2px 只有2个轨道参与杂化,形成2个新的简并轨道(sp+sp+p+p),形成2个σ鍵,键角180度,剩余2个p轨道形成π键。 例子:C2H2 关于氮原子的杂化: sp3杂化 参与杂化价电子的原子轨道:2s+2px+2py+2pz 所有4个价电子均参与杂化,形成4个新的简并轨道(sp3+sp3+sp3+sp3),其中3个轨道都形成3个σ鍵,键角107度,另外一个形成孤电子对。 例子:NH3 sp2杂化 参与杂化价电子的原子轨道:2s+2px+2py 4个轨道中的3个参与杂化,形成3个新的简并轨道(sp2+sp2+sp2+p),形成2个σ鍵(键角120度)与1个孤电子对,剩余一个p轨道未参与杂化,形成一个π键。 例子:CH2NH sp杂化 参与杂化价电子的原子轨道:2s+2px 只有2个轨道参与杂化,形成2个新的简并轨道(sp+sp+p+p),形成1个σ鍵与1个孤电子对,剩余2个p轨道未参与杂化,形成2个π键。 例子:CH3CN https://blog.sciencenet.cn/blog-1248257-781204.html 上一篇:TEM/STEM详细基本构造以及各部件作用(照明+成像部分)下一篇:关于法语复合过去时谓语与直接宾语的一致性 收藏 IP: 155.210.233.*| 热度| |
【本文地址】
今日新闻 |
推荐新闻 |