医访谈 |
您所在的位置:网站首页 › ccr小于多少要接受治疗可改善预后 › 医访谈 |
医访谈
|
医访谈|张志红教授:综合评估术后辅助治疗预后因素,提升肺癌患者生存获益
2022-05-24 16:07:43 0肺癌是最常见的恶性肿瘤之一,全球范围内肺癌的发病率、死亡率都极高且呈现上升趋势。目前手术仍是早期和部分局限期(Ⅰ~ⅢA期)肺癌的主要治疗手段,但由于存在微转移病灶,手术后仍易出现复发、转移。随着肺癌综合治疗的发展,更好的支持治疗的出现以及临床实践模式的改变,肺癌的疗效及其预后也有了明显的改变。目前临床上普遍采用肿瘤分期系统(TNM分期)作为肺癌治疗指导和预后评估的重要手段,但仍存在一定局限性,因此如何更全面地综合评估肺癌的预后因素筛选获益人群至关重要。《医师报》特别邀请到中国科学技术大学附属第一医院西区张志红主任谈谈肺癌的预后因素及辅助治疗的风险评估。
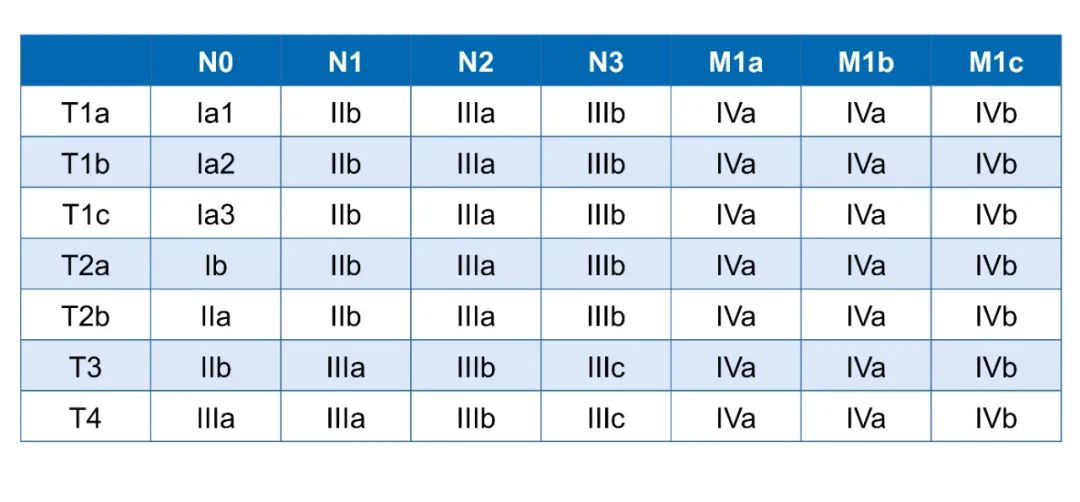
01 NSCLC术后辅助治疗可降低术后复发率 提高患者生存获益 肺癌分别是男性和女性人群恶性肿瘤发病率的第一位和第二位 [1],其中非小细胞肺癌(NSCLC)约占85%,其中30%~40%被认为是可切除的肿瘤[2]。根据第八版国际肺癌TNM分期Ⅰ-ⅢA期肺癌治疗以手术为主,但因NSCLC早期并无明显症状,多数患者确诊时已发展至中晚期错失手术时机[3]。随着肺癌早期筛查的普及,规范化筛查提高了手术机会和治疗效果及生活质量。但即使NSCLC患者接受了完全性切除手术,仍有30%-50%的患者会出现复发或转移导致治疗失败[4]。共识指南支持对复发风险较高的肿瘤进行辅助或新辅助化疗[5],有助于降低术后复发风险,提高患者生存获益,但如何识别有复发高风险的患者和有可能从辅助治疗获益的患者仍有待探索。 目前我国指南认为,围手术期治疗是改善早期NSCLC手术患者预后的最佳选择[6],对于ⅠA期NSCLC完全性切除术后的患者应进行定期随访;而根据术后肿瘤分期,ⅠB期患者术后辅助治疗需进行多学科评估,评估每例患者的术后辅助化疗的益处与风险,有高危险因素者推荐术后辅助化疗。当前局限期 NSCLC患者的整体预后有待提升,临床上未被满足的需求仍然很高。因此,迫切需要更多的手段来帮助我们区分和鉴别术后复发的高危风险人群。 02 综合评估NSCLC辅助治疗的高危风险 关注患者相关及肿瘤相关的病理学临床预后因素 NSCLC异质性大且预后不佳,选择适当的治疗策略至关重要,因此需要对局限期NSCLC进行更好的预后分层,以确定复发风险最高的患者,并避免对其他患者进行不必要的治疗[6]。年龄是独立的影响因素,年龄越大复发的可能越大。 无论疾病的阶段如何,性别都是重要预后因素,总体来说女性患者预后优于男性患者。此外,体力活动状态评分即患者日常活动能力,体力状况亦与预后直接相关。营养状况欠佳以及体重指数过低也是导致局限期NSCLC预后不良的重要因素。吸烟饮酒是高危因素,戒烟者的生存时间通常比确诊后继续吸烟的人更长,戒烟戒酒有利于降低术后复发率[6]。 在肿瘤相关的病理学临床预后因素上,TNM分期系统是当前临床上最普遍的评估方法,其不仅是肺癌患者选择适当治疗手段的重要依据,也是评估肺癌患者预后的独立影响因素(图1)。第八版国际肺癌TNM分期着重强调了肿瘤大小对预后的影响。在Ⅰ期手术患者中,肿瘤大小是最重要的预后因素之一[6]。而随着肿瘤大小每增加1cm,T分期对总生存时间的影响更大,死亡风险随肿瘤大小增加。对于同一级别的N分期中,临床分期与病理分期生存率差异较大,而病理分期往往更能够反映真实的分期情况。 淋巴结转移站数及是否存在跳跃性转移对预后会产生重要影响,伴有多站转移及存在跳跃性转移患者预后明显变差[6],第八版TNM分期中将原来的N1细分为N1a(单站转移)和N1b(多站转移),N2分为N2a1(无N1转移,直接跳跃到N2的淋巴结)、N2a2(有N1淋巴结转移,同时发生单站N2淋巴结转移)和N2b(多站N2淋巴结转移)。M分期中转移性患者并不适合手术,然而在手术过程中或解剖病理学检查过程中,可能意外发现第二个解剖病理学结节或胸膜浸润,影响患者预后及肿瘤分期判断[6]。
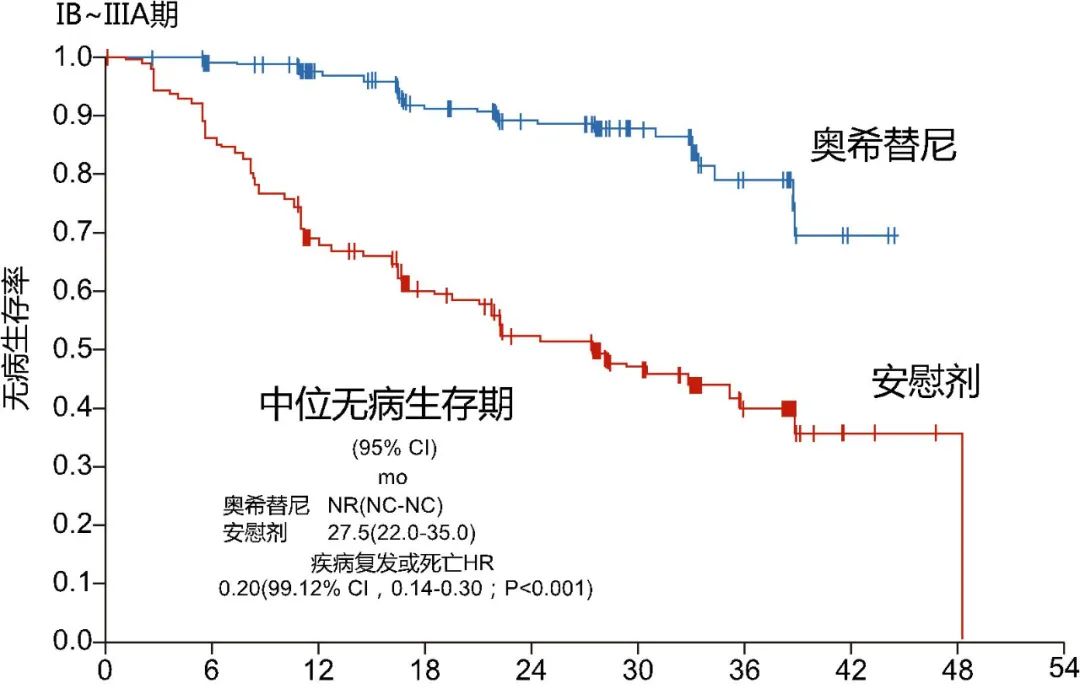
图1 第八版国际肺癌TNM分期 组织学类型通常作为一个独立的预后因素,不具有完全的可再现性[6]。国际肺癌研究组/美国胸科协会/欧洲呼吸协会引入基于手术切除确定的肺腺癌组织预后分类,可依此判断预后不良的患者以便评估辅助治疗策略选择[6]。评估NSCLC高危因素,选择合适的术后辅助治疗策略对于降低局部复发或远处转移的风险尤为重要。 根据组织学类型相同分期下,鳞癌的Ⅰ期切除生存率高于腺癌,而肉瘤样癌、微乳头样癌、实体瘤、胶质性、黏液性等类型预后较差,此类预后不佳的患者可考虑进一步辅助治疗。另外,原位腺癌的预后较好,而间质内发现肿瘤细胞可能提示预后差。此外,肿瘤侵犯壁层胸膜、脉管侵犯、淋巴管侵犯、神经侵犯、气道内播散等病理改变的预后较差[6]。 03 细化NSCLC复发风险评估分层 驱动基因突变检测实现精准治疗 随着肺癌精准治疗理念的深入,基于驱动基因突变检测的分子分型占据重要地位[6],在临床实践中已成为肺癌治疗策略选择的重要标准,许多基于基因特征的肺癌临床研究相继开展。EGFR突变是NSCLC常见的驱动基因,因EGFR突变细胞易形成远处早期微转移环境,或肿瘤突变负荷较低更有可能逃避免疫监视,使得EGFR突变的远期复发风险较高,目前治疗方案首推酪氨酸激酶抑制剂(TKI)靶向治疗。 在ADAURA研究[7]中纳入可切除的EGFR突变ⅠB-ⅢA期NSCLC患者,研究结果显示术后使用奥希替尼可以明显延长患者的中位无病生存期(DFS),降低了患者复发或死亡的风险(图2),为肺癌术后患者带来治愈希望。但基于此类药物的安全性和经济性,仍建议临床进一步细分适应人群提高患者临床获益。 由于ALK突变无进展生存期(PFS)较长,目前术后辅助治疗临床研究仍在进行中。此外,BRAF、ROS1、MET、KRAS等驱动基因因突变率不高临床研究尚待开展[6]。
图2 ADAURA研究次要终点:整体人群DFS(ⅠB期、Ⅱ期、ⅢA期) 作为NSCLC中常见的突变位点,常见的TP53、KEAP1等肿瘤抑制基因对于NSCLC,尤其是局限期肿瘤预后的影响尚不明确,但更近期证据显示,无论接受何种治疗,STK11/LKB1或 KEAP1突变的NSCLC预后均较差[6],STK11的免疫治疗反应较差,也应在辅助治疗策略选择中引起注意。此外,尽管肿瘤突变负荷(TMB)在多项临床试验中均表现出良好的预测作用,但仍需更多的前瞻性研究证实TMB的预测作用[6]。 确定辅助治疗的效益/风险平衡非常重要,预后相关分子标志物有助于辅助靶向治疗策略选择。术后循环肿瘤基因(ctDNA)检测可作为中高复发风险的预后因素特异性较高,可作为存在微小残留病灶(MRD)的标志物[6],但对检测方法及平台、检测深度要求较高。ctDNA 的变化有可能早于影像学的监测结果,评估患者是否有复发转移的可能,研究表明ctDNA检测可较影像学改变早88天[8]。此外,基因表型和基因特征的检测也是预后评估方法之一。 04 新辅助治疗前景广阔 但仍有待进一步探索精准的疗效预测标志物,筛选获益人群 目前OS被认为是衡量疗效的金标准,常被作为大型随机研究的首要指标,但由于新辅助治疗获得成熟的OS数据往往需要较长时间,多数新辅助试验的主要终点为主要病理缓解(MPR)和病理完全缓解(pCR)。Ulas等人的荟萃分析发现[9],单纯免疫治疗组MPR高达45%,而免疫化疗组MPR更高,可达27%-86%。 虽然新辅助免疫治疗前景光明,但并非对临床中所有患者有效,如术前新辅助治疗可能导致手术延迟甚至失去手术机会,影响最终治疗效果。目前单一生物标志物已难以满足临床需要,需联合多项指标检测综合评估,但标志物在应用层面尚未形成共识,因此如何筛选更精准的分子标志物或者分子标志物谱仍有待进一步探索。而临床仍需要探索更好的预测新辅助免疫治疗后患者生存获益的技术及方法,需要精准预测疗效的生物标志物来筛选获益人群。 05 张志红教授总结 规范化筛查肺癌术后复发中高风险人群,及时掌握肿瘤的动态进展对NSCLC的早诊早治意义重大。当前局限期肺癌生存率评估主要依赖于肿瘤分期系统,但患者接受辅助治疗后总体获益仍然较低,NSCLC的临床表现、组织病理学、治疗反应以及术后复发风险等情况判断相对复杂,其预后评估可能最终还需依赖临床、组织学、分子标志物等多项指标综合评估,以筛选最佳获益人群。随着临床和基础研究的不断深入,NSCLC诊疗体系将日趋完善成熟,患者整体获益必将提升。 专家简介
张志红 教授 中国科学技术大学附属第一医院西区 医学博士,主任医师,副教授,硕士生导师 中国科学技术大学附属第一医院西区(安徽省肿瘤医院)呼吸肿瘤科主任 安徽省老年医学学会肺癌专业委员会 主任委员 安徽省预防医学会肺癌预防与控制专业委员会 副主任委员 中国医药教育协会肿瘤转移专业委员会 常委 安徽省医学会呼吸病学分会 委员 安徽省医师协会呼吸病学医师分会 委员 安徽省卫生厅青年领军人才 安徽省学术技术带头人后备人选 2015-2018美国Tennessee 大学医学中心博士后 2011年德国Ruhrlandklinik进修肺癌的介入治疗和间质性肺疾病 参考文献:(滑动查看) [1].Cancer Today.WHO. [EB/OL]https://gco.iarc.fr/. [2].Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020 Jan;70(1):7-30. [3].Goldstraw P, Chansky K, Crowley J, et al.The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016 Jan;11(1):39-51. [4].Bravis V, Kaur A, Walkey HC, et al. Relationship between islet autoantibody status and the clinical characteristics of children and adults with incident type 1 diabetes in a UK cohort. BMJ Open. 2018 Apr 4;8(4):e020904. [5].中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肿瘤学分会肺癌临床诊疗指南(2021版).中华肿瘤杂志. 2021; 43(06):591-621. [6].Garinet S, Wang P, Mansuet-Lupo A, et al. Updated Prognostic Factors in Localized NSCLC. Cancers (Basel). 2022 Mar 9;14(6):1400. [7].Wu YL, Tsuboi M, John T, et al. A plain language summary of results from the ADAURA study: osimertinib after surgery for patients who have early-stage EGFR-mutated non-small cell lung cancer. Future Oncol. 2021 Dec 1;17(35):4827-4835. [8].Qiu B, Guo W, Zhang F, et al. Dynamic recurrence risk and adjuvant chemotherapy benefit prediction by ctDNA in resected NSCLC. Nat Commun. 2021 Nov 19;12(1):6770. [9].Chaft JE, Shyr Y, Sepesi B, et al. Preoperative and Postoperative Systemic Therapy for Operable Non-Small-Cell Lung Cancer. J Clin Oncol. 2022 Feb 20;40(6):546-555. 排版:李慧 编辑:王丽娜 审核:秦苗 特别声明:本文为人民日报新媒体平台“人民号”作者上传并发布,仅代表作者观点。人民日报提供信息发布平台。 分享到:
0 
写下你的评论 评论 热门评论{{item.content}} 最新评论{{cell.content}} {{item.content}} 已加载全部内容 |
【本文地址】
今日新闻 |
推荐新闻 |
 医师报肿瘤频道
医师报肿瘤频道