CAR |
您所在的位置:网站首页 › ccrf-cem细胞 › CAR |
CAR
|
研究者充分调研了各种T细胞肿瘤的Marker,并从中选择了T细胞泛标记抗原CD5和CD7。CD5是一种T细胞表面标记物,存在于约85%的T细胞恶性肿瘤中及一些B细胞恶性肿瘤。CD7是一种跨膜蛋白,也是T细胞表面的高特异性靶点,在90%以上的淋巴母细胞性T细胞白血病和淋巴瘤以及约30%的急性髓系白血病中均有表达,但是该蛋白对T细胞的功能影响似乎有限。基于此考虑,研究者将两者抗原相结合,期望可进一步提高疗效,扩大患者范围且进一步对比了串联(Tan)和并联(Dual)两种不同的结合方式(如图2a)。 首先,研究者考虑到CAR-T疗法存在“自相残杀”的风险,在双特异性CAR的慢病毒转导之前进行了基于CRISPR/Cas9的CD5和CD7基因敲除。通过对比敲除CD5和CD7基因与未敲除基因的T细胞在增殖、生存能力、CD4/CD8阳性比率、表型方面的差异,来评估基因敲除步骤是否会影响细胞功能。结果表明基因敲除步骤对细胞无明显影响。
在确保基因编辑对T细胞无影响之后,研究者进一步检测了单、双靶点,双靶点的并联与串联CAR在细胞上的表达情况,所有组的CAR都能成功的表达在CD5CD7KO T细胞上,但是Dual CAR的表达要低于Tan CAR, 可能是因为Dual CAR 需要转入更长的片段,如图2所示。
在确定了CAR的表达情况后,接着研究者选取了Jurkat, CCRF-CEM, MOLT-4和 SUPT1四种T细胞恶性肿瘤细胞及分别敲除CD5或CD7的CCRF-CD5KO/CCRF-CD7KO细胞作为实验细胞(各个细胞CD5/CD7的检测见图3a),CD5-CD7-双阴的Raji细胞作为对照细胞探索了CAR是否能够有效的被CD5+ 和/或CD7+细胞激活,能否发挥CAR对肿瘤细胞杀伤功效。首先研究者检测了各个细胞与CAR-T细胞共培养后CD107a(脱颗粒作用的标志物)的表达情况,结果表明Tan7-5 CART细胞在与6种细胞刺激下,CD107a的表达量都明显有上调;且CCRF-CD7KO细胞中,与Dual CAR-T相比,Tan7-5 CART的表达量具有显著性差异(图3c)。
此外,研究者还检测在各个实验细胞刺激CAR-T细胞后,CAR-T细胞表面CD69/CD25的表达情况,以此来判断CAR-T细胞是否被激活。与未被刺激的CAR-T细胞相比,共培养的双靶点CAR-T细胞表面CD69/CD25表达量都具有明显上调,而单靶点CAR-T确存在部分未激活的状态(如图3d),这进一步说明了双靶点CAR-T细胞靶向范围更加广泛。 随后,研究者通过CAR-T细胞对肿瘤细胞杀伤力、CAR-T细胞的增殖等的检测来观测双靶点CAR-T细胞的细胞毒性功能(图4)。结果显示CD5/CD7 双特异性CAR-T 细胞以剂量依赖性方式选择性杀伤肿瘤细胞。经过多轮抗原刺激下, Dual CAR-T相比其他类型的CAR-T细胞表面表达的衰竭相关标志物如 PDCD1、CTLA4、TIGIT 和 LAG-3 的表达更高,而与 T 细胞杀伤作用相关的 GZMB 和FasL 基因的更低表达。
既然CD5/CD7 双特异性 CAR-T在体外实验中表现出良好肿瘤杀伤能力,也能在抗原的持续刺激下能够表现出良好的增殖能力,那么 CAR-T在体内的表现如何呢?通过对比实验发现,所有实验组都观察到CDX模型鼠中肿瘤抑制表现,且肿瘤模型小鼠的存活时间延长,但是在体重上无明显差别(如图5)。
最后,通过对比,研究者发现在异种移植肿瘤模型中,相比于Dual CRA-T, Tan CAR-T在杀伤活性和防止肿瘤逃逸方面更有效(图6)。
综上所述,敲除CD5和CD7可防止CD5/CD7双特异性CAR-T细胞自相残杀,并且串联双靶向CAR 在杀伤活性和防止肿瘤逃逸方面比并联双靶向CAR更有效。上述研究结果为T细胞肿瘤治疗提供了有效的新思路和新策略。
|
【本文地址】
今日新闻 |
推荐新闻 |
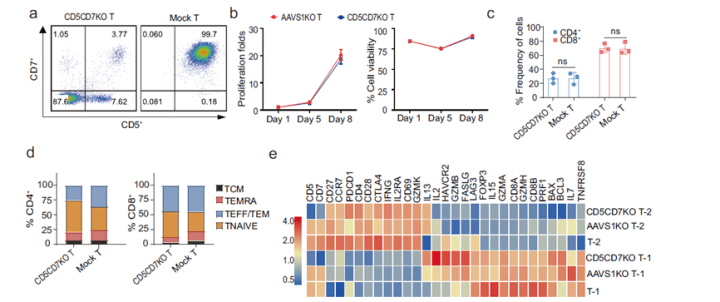 图1. 基因敲除对细胞功能的影响
图1. 基因敲除对细胞功能的影响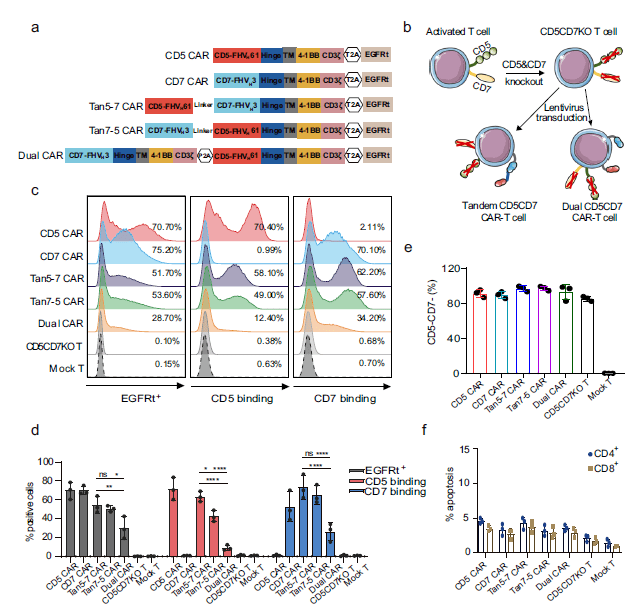 图2. 单、双靶点,双靶点的并联与串联CAR在细胞上的表达情况
图2. 单、双靶点,双靶点的并联与串联CAR在细胞上的表达情况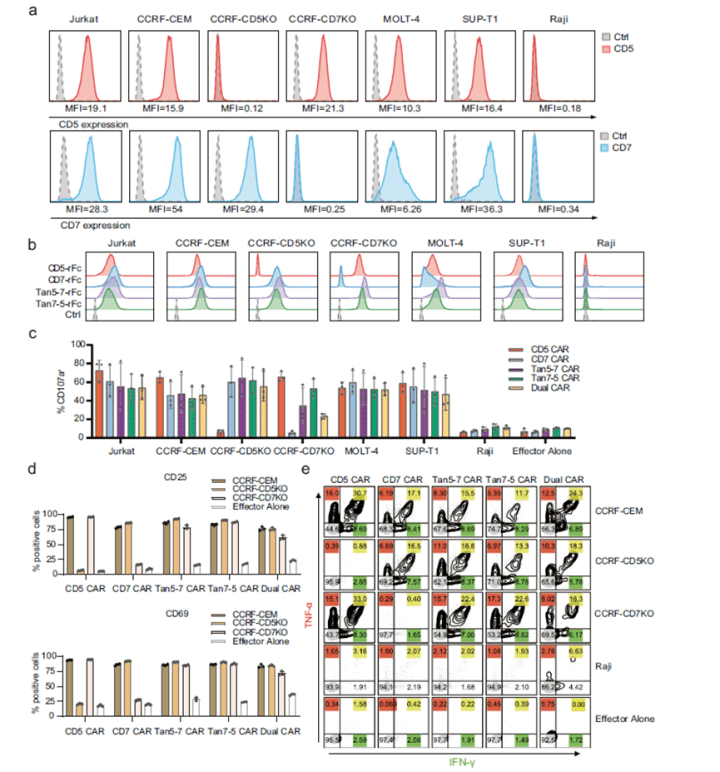 图3. 双特异性CAR-T细胞有效地被CD5+ 和/或CD7+细胞激活
图3. 双特异性CAR-T细胞有效地被CD5+ 和/或CD7+细胞激活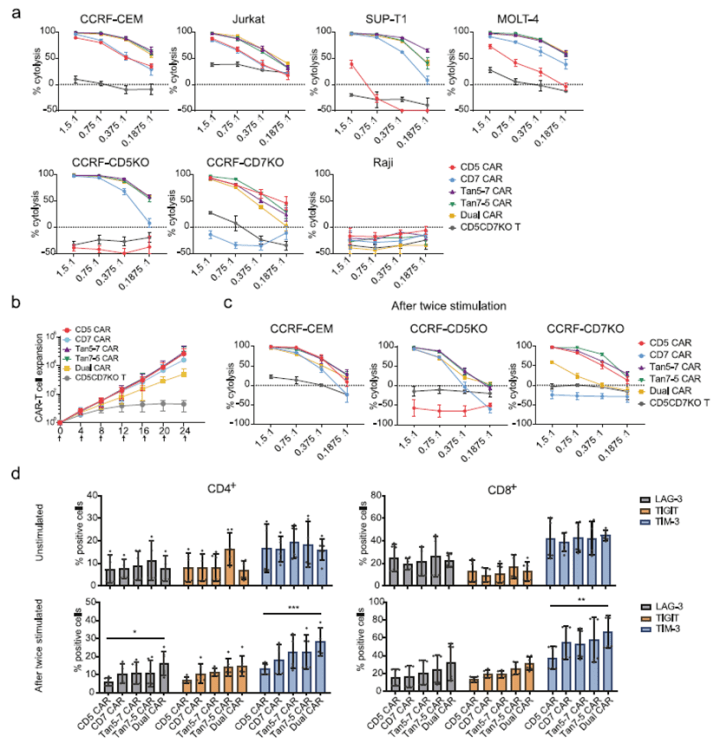 图4. CAR-T细胞对肿瘤细胞杀伤能力及细胞的增殖能力检测结果
图4. CAR-T细胞对肿瘤细胞杀伤能力及细胞的增殖能力检测结果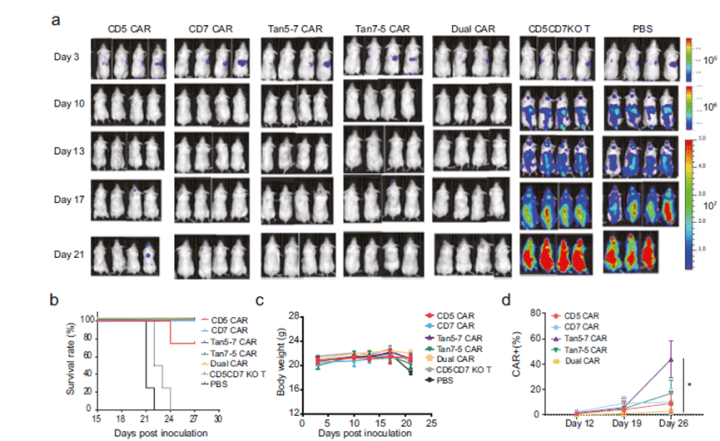 图5. CAR-T细胞肿瘤杀伤能力体内实验验证
图5. CAR-T细胞肿瘤杀伤能力体内实验验证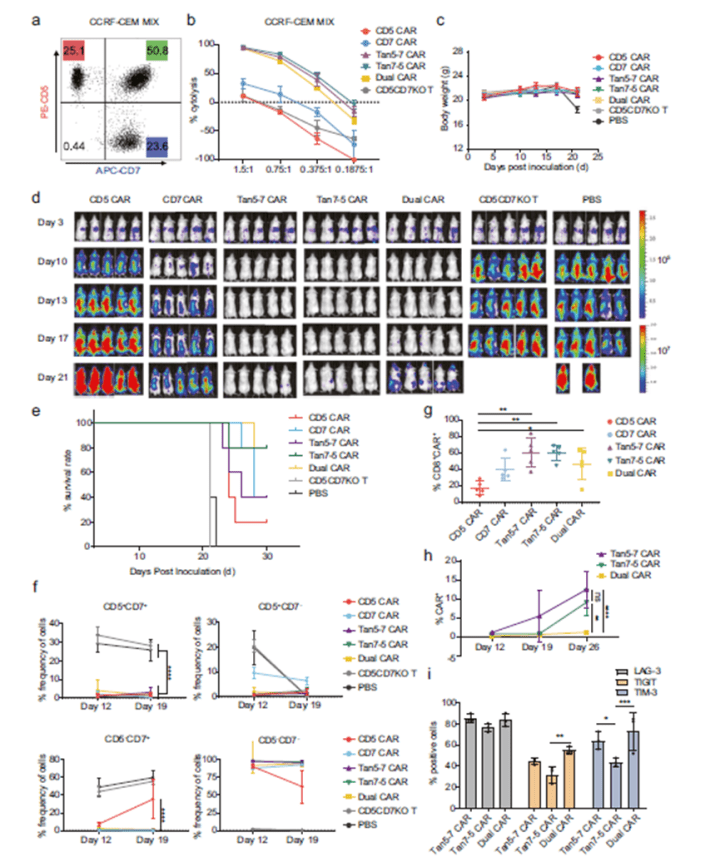 图6. CD5/CD7双特异性 CAR-T细胞减轻了单一抗原逃逸
图6. CD5/CD7双特异性 CAR-T细胞减轻了单一抗原逃逸
 返回搜狐,查看更多
返回搜狐,查看更多