Ni催化甲酰胺苄位β |
您所在的位置:网站首页 › c-h键和c-c键 › Ni催化甲酰胺苄位β |
Ni催化甲酰胺苄位β
|
Ni催化甲酰胺苄位β-C(sp³)–H键活化
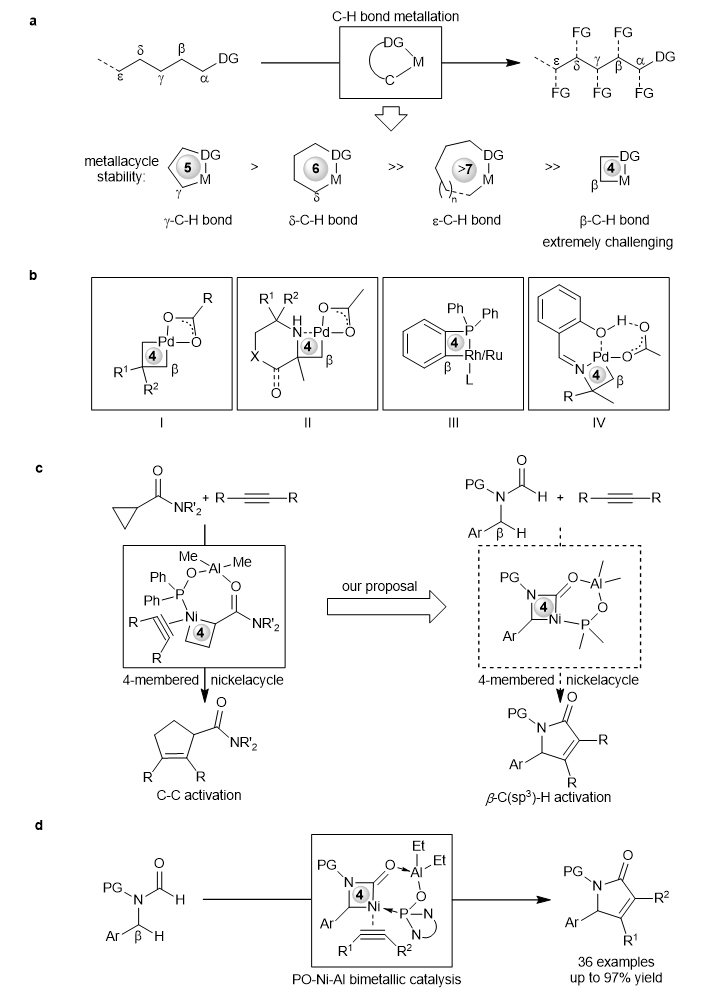
近日,南开大学叶萌春(点击查看介绍)课题组使用二胺衍生的膦氧配体(PO)桥联Ni-Al双金属催化剂通过四元张力镍环中间体实现了甲酰胺双C–H键活化,合成了一系列α,β-不饱和γ-内酰胺。相关成果发表在Nature Communications 上。 环金属化是过渡金属催化C-H活化的最有效途径之一。在过去几十年里,各种导向基(DG)辅助下的过渡金属环金属化已经取得了显著的成就。然而,大多数例子都是通过形成稳定的五元金属环中间体来活化配位原子的γ-位的C-H键(图1a)。相比之下,通过形成较大或较小非五元金属环中间体来活化非γ-C–H键面临着相当大的挑战,因为存在不利的熵效应或环张力。在各种非γ-C–H键中,β-C–H键通常最难活化,因为需要形成环张力很高的四元金属环。到目前为止,通过四元金属环活化β-C–H键的例子非常少,仅包括烯烃碳钯化或芳基卤化物的1,4-钯迁移活化β-C–H键(图1b, I),大位阻胺或膦导向的四元钯环活化β-C–H键(II和III),以及含羟基的双齿导向基通过四元钯环活化各种叔胺底物β-C–H键(IV)。尽管取得了很大进展,但这些方法都必须依赖于钯、铑和钌等贵金属催化剂,难以应用于价廉易得的3d过渡金属催化剂。因此,发展3d过渡金属催化的四元金属环介导的非活性β-C(sp3)–H键的活化具有重要的研究意义和应用价值。在之前环丙烷C–C键活化工作中(J. Am. Chem. Soc. 2017, 139, 18150),作者发现膦氧配体(PO)连接的Ni–Al双金属催化剂可以形成双环结构来稳定四元镍环中间体(图1c,左)。受此启发,作者设想利用PO–Ni–Al催化体系通过类似的四元镍环中间体来活化甲酰胺的β-C(sp3)–H键(图1c,右),从而获得廉价3d过渡金属催化双C–H键参与的[3+2]环加成反应。最终,作者实现了Ni催化的甲酰胺的双C–H键与炔烃的[3+2]环加成反应,合成了一系列α,β-不饱和γ-内酰胺,收率高达97%(图1d)。在反应中,PO–Ni–Al双金属催化剂形成了稳定的双环中间体,对反应活性的提升和位点选择性控制起着关键的作用。机理研究和密度泛函理论计算(DFT)表明,甲酰基C–H键的活化是通过配体-配体直接氢迁移(LLHT)实现的,而炔烃迁移插入四元镍环是反应的决速步。
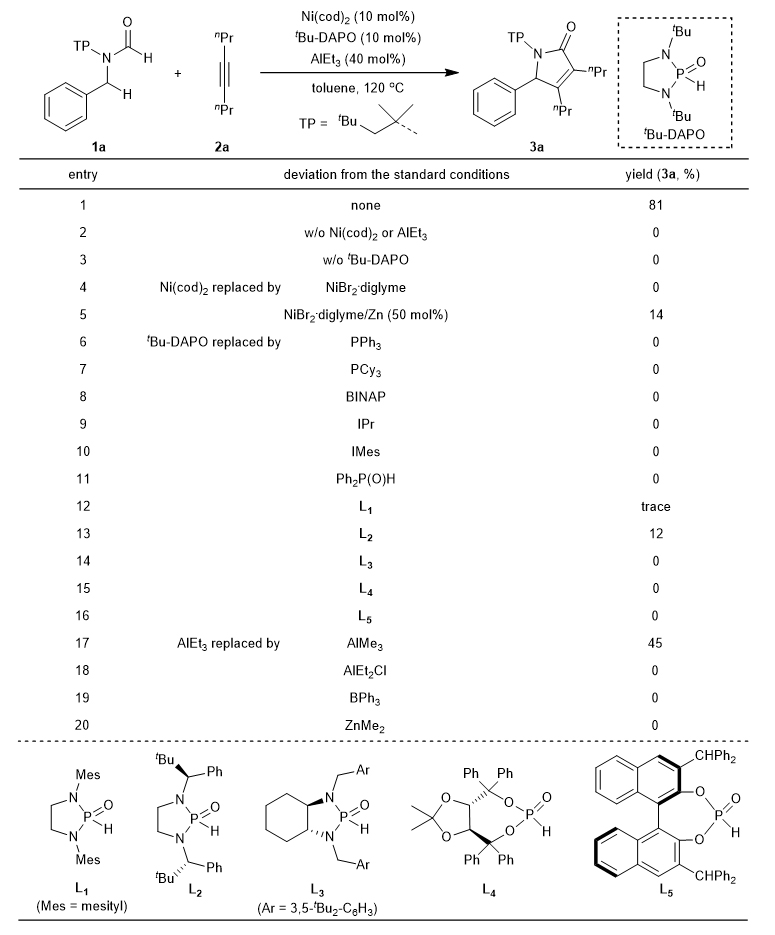
图1. 过渡金属通过环金属化催化C-H活化。 作者选择N-苄基甲酰胺1a和4-辛炔2a作为模板底物,对条件进行了考察(图2)。当膦氧配体tBu-DAPO作为反应配体,AlEt3作为路易斯酸,在120 ℃条件下,可得到81%的收率。
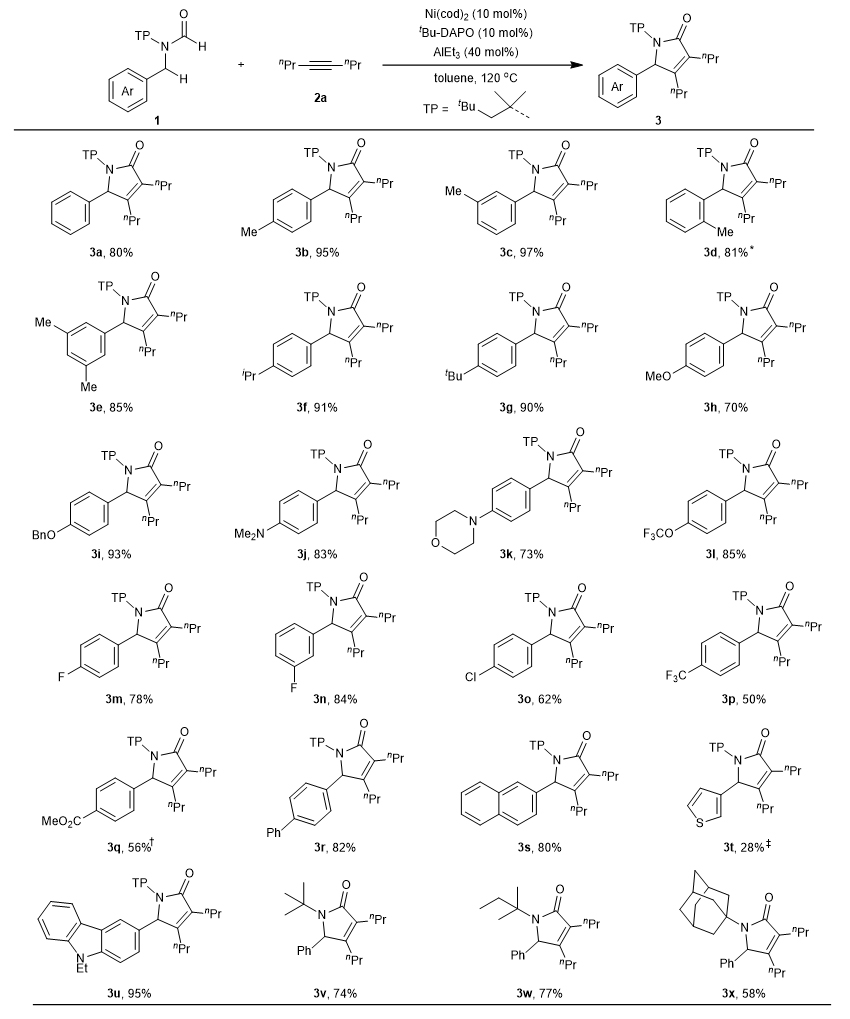
图2. 反应条件优化 随后作者对甲酰胺的底物范围进行考察(图3)。结果显示,苯环上引入各种吸电子和给电子取代基以及不同位点的取代基都能得到较高的收率。但是当引入OMe时,由于O原子会与Al配位,反应的活性会明显降低。此外,咔唑、噻吩等杂环也能在反应中被很好地兼容。反应中,N-保护基至关重要,一般需要较大位阻基团(如叔丁基、叔戊基和金刚烷基等),才能促进β-C–H键的活化,并抑制保护基上烷基的活化。
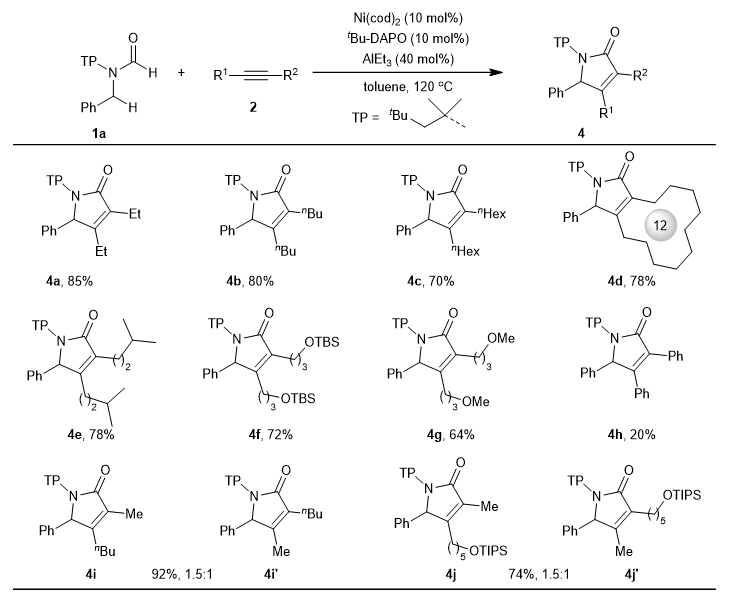
图3. 底物拓展-甲酰胺 接下来作者考察了炔烃的范围(图4)。对于烷基炔烃,吸电子和给电子取代基都具有较好的兼容性,同时不对称炔烃也能得到较好的结果。然而,二苯炔的反应收率较低。作者观察到反应体系加入二苯炔后,反应中很快有固体沉淀析出。作者推测析出的固体沉淀可能是镍与二苯炔的络合物,如π-络合物或五元环镍络合物等,从而抑制了反应的活性。
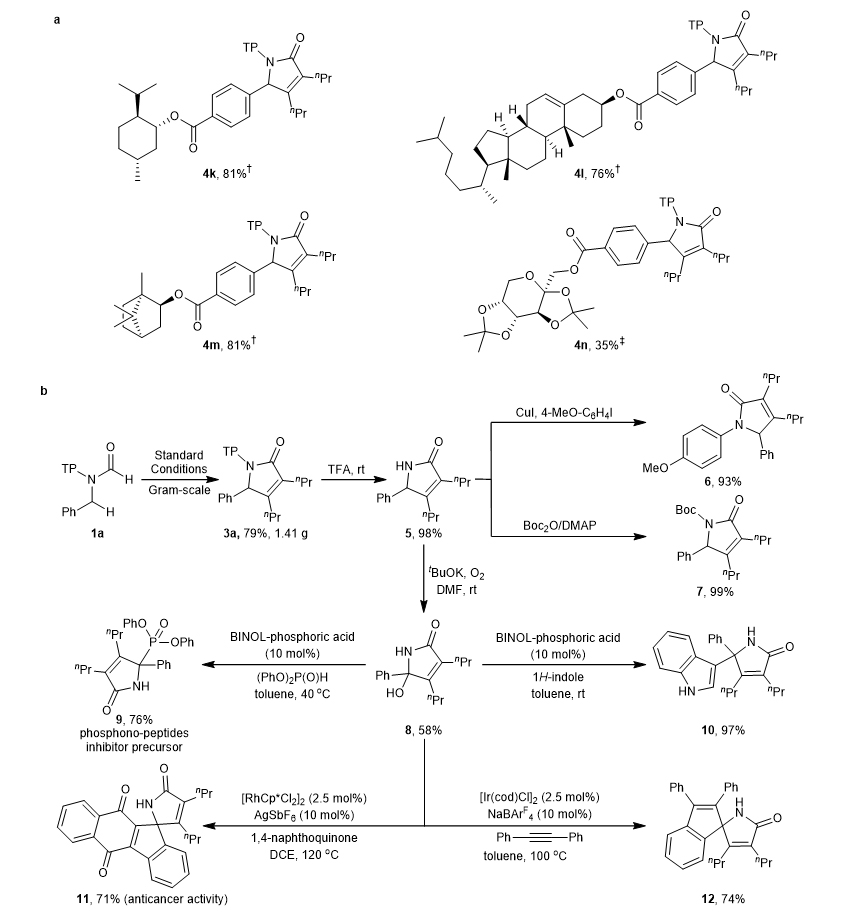
图4. 底物拓展-炔烃 为了验证当前方法的实用性,首先,作者研究了一系列含有生物活性基团的底物,如薄荷醇(4k)、胆固醇(4l)、冰片(4m)和二丙酮果糖(4n),收率可达35-81%(图5a)。其次,克量级反应可以在几乎不损失产率的情况下得到3a产物。另外,在温和的条件下,用三氟乙酸可以很容易的脱除2,4,4-三甲基戊烷-2-基(TP)保护基,从而以98%的收率得到吡咯烷酮5。化合物5经碘化芳基和(Boc)2O处理后,分别以93%和99%的收率得到4-甲氧基苯基吡咯烷酮6和Boc-吡咯烷酮7。同时在氧化条件下,化合物5的苄位C-H键可以被轻松氧化,得到一种多功能的合成前体胺8,收率为58%。胺8原位脱水可生成相应的亚胺,然后和二苯膦酸酯或吲哚反应,得到收率76%的季碳化合物9和97%的含碳化合物10。在次基础上,以亚胺为导向基团可以实现Rh或Ir催化C–H键活化,随后与1,4-二氢醌和炔烃环化,形成螺旋体化合物11和12。
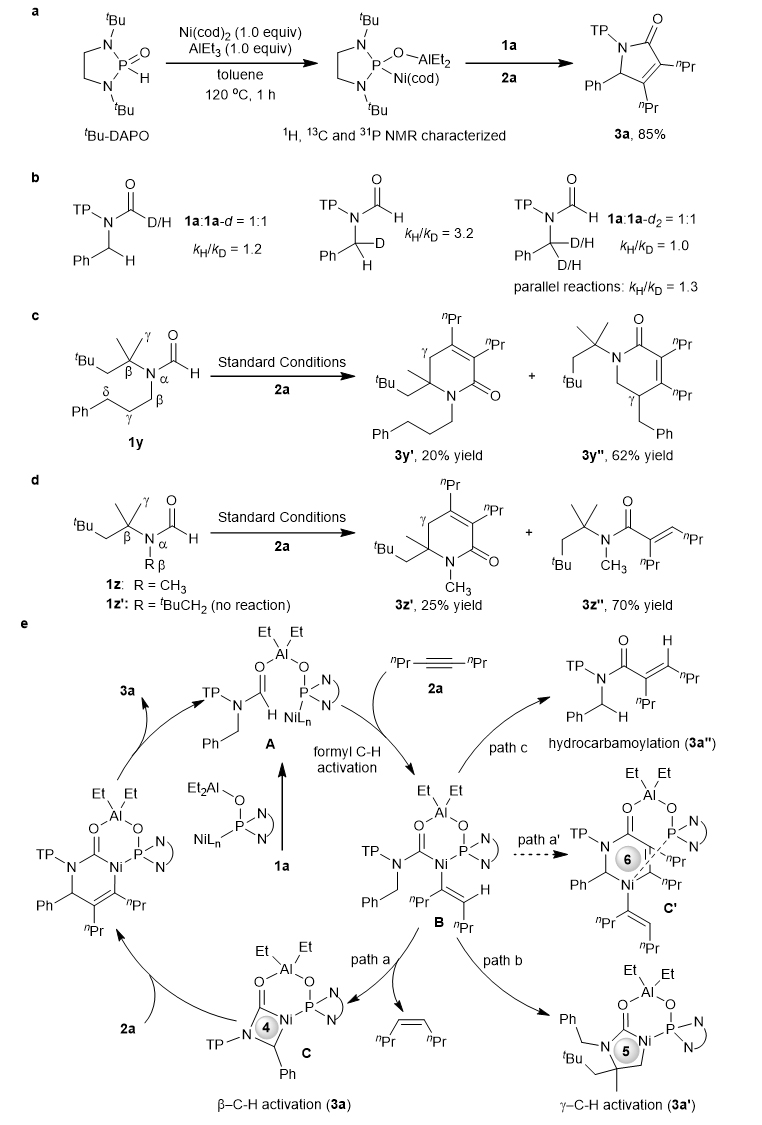
图5. 合成应用 作者还进行了相关的机理实验研究。首先,tBu–DAPO连接的Ni–Al双金属催化剂被制备出来,并通过1H、13C和31P NMR进行了表征(图6a)。当向该双金属配合物中加入底物1a和2a时,产物3a的收率可达85%,表明tBu–DAPO–Ni–Al可催化环加成反应。其次,氘标记实验揭示了甲酰基C–H键的低同位素效应(kH/kD = 1.2)(图6b,左)。进一步对苄位C–H键进行分子内和分子间竞争实验,得到相应的kH/kD值分别为3.2和1.0(图6b,中,右)。此外,平行反应也发现苄基C–H键的低同位素效应(kH/kD = 1.3)。这些结果表明,甲酰基C–H键和苄位C–H键的活化均非决速步,而高kH/kD(3.2)意味着苄位C–H键的解离可能是一个不可逆过程。第三,作者还测量了炔烃的反应速率级数,发现反应对炔烃为一级反应,即在决速步中,只有一分子炔参与了反应,暗示该反应经历的是四元镍环机理而不是对炔烃呈二级反应的六元镍环机理。第四,如果苄基换成3-苯丙基,那么反应主要生成γ-C(sp3)–H键活化的副产物(图6c),相应副产物3y′收率为20%而3y″收率为62%,未观察到β-C(sp3)–H键活化。这一结果证实了β-C(sp3)–H键的活化比普通γ-C(sp3)–H键更难。此外,如果苄基换成简单甲基取代苄基,则反应主要生成γ-C(sp3)–H键活化的副产物3z′,收率为25%,而氢甲酰化副产物3z″的收率为70%(图6d)。如果苄基换成tBuCH2基,那么反应不发生。这些结果表明苯基的存在对β-C(sp3)–H键活化至关重要。在这些机理实验的基础上,作者提出了可能的反应机理,见图6e。底物1a与双金属催化剂配合,甲酰基C–H键活化生成中间产物B,中间产物B经过苄基C–H键活化生成4元镍环C(路径a)。随后炔烃插入和还原消除得到所需产物3a并再生双金属催化剂。中间体B可能经过γ-C(sp3)–H键活化,形成更稳定的五元镍环(路径b),最终生成副产物3a′。此外,中间体B直接还原消除可得到氢甲酰化副产物3a″(路径c)。但是,机理实验和DFT计算已经排除经由六元环镍中间体的机理(路径a′)-中间体B先与炔烃迁移插入,然后活化苄位C–H键形成六元镍环。
图5. 转化与机理 总结 南开大学叶萌春课题组使用二胺衍生的膦氧配体(PO)桥联Ni–Al双金属催化剂通过四元镍环中间体实现了甲酰胺苄位β-C–H键的活化,以及双C–H键参与的[3+2]环加成反应,合成了一系列α,β-不饱和γ-内酰胺,收率高达97%。机理实验和DFT计算表明,PO连接Ni–Al双金属催化剂以及大位阻的N-保护基对获得良好的收率和选择性的起着关键作用。该方法有望应用于其他3d过渡金属催化的四元金属环介导的β-C–H键的活化。 原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):
Ni-catalyzed Benzylic β-C(sp3)–H Bond Activation of Formamides Rong-Hua Wang, Wei-Wei Xu, Hongli Wu, Yue Li, Jiang-Fei Li, Tao Zhang, Genping Huang,* and Mengchun Ye* Nat. Commun., 2022, 13, 7892, DOI: 10.1038/s41467-022-35541-6 导师介绍 叶萌春 https://www.x-mol.com/university/faculty/40458 课题组网站 http://www.yechem.cn/ 如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载! 点击分享 收藏 取消收藏 评论: 0 |
【本文地址】