BCA法、Bradford法、Lowry法など、“総”タンパク質定量法の原理まとめ|知っておきたい!タンパク質実験あれこれ 第4回 |
您所在的位置:网站首页 › bca蛋白定量吸光度 › BCA法、Bradford法、Lowry法など、“総”タンパク質定量法の原理まとめ|知っておきたい!タンパク質実験あれこれ 第4回 |
BCA法、Bradford法、Lowry法など、“総”タンパク質定量法の原理まとめ|知っておきたい!タンパク質実験あれこれ 第4回
|
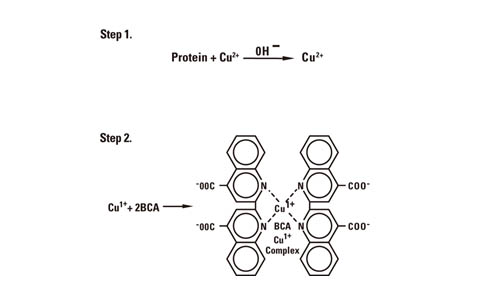
第4回目の今回は、 前回に引きつづき「総タンパク質定量法」をテーマとして、弊社の総タンパク質定量試薬製品の原理や特徴について解説します! 今回のテーマは「総タンパク質定量法の種類と原理まとめ」と題して、弊社の総タンパク質定量試薬製品の特徴と目的に合わせた選択方法についてご紹介します!” ▼もくじ BCA法BCA法の化学反応BCA法のメリットBCA法のデメリットBradford (Coomassie)法Bradford (Coomassie)法の化学反応Bradford (Coomassie)法のメリットBradford (Coomassie)法のデメリットLowry法Modified Lowry Protein Assayの化学反応Lowry法のメリットLowry法のデメリットPierce 660 nm Protein Assay法Pierce 660 nm Protain Assay法の特長最後に【無料ダウンロード】タンパク質解析ワークフローハンドブック BCA法BCA タンパク質定量法は、1985年にPaul K. Smithらによって紹介されました。このBCA法の大きな特長は、それまでBradford (Coomassie)ベースの方法では困難であった界面活性剤を含む溶液の測定についても可能になったことです。 弊社のBCA総タンパク質定量用キットでは、オリジナルのBCA Protein Assay Kitに加え、反応時間が5分に短縮されたRapid Gold BCA Assay Kit、低濃度タンパク質溶液(0.5-20 µg/mL)の測定用に開発されたMicro BCA Protein Assay Kit、従来は原理的に困難であった還元剤含有サンプルについても測定できるように改良されたBCA Protein Assay Kit – Reducing Agent Compatible、マイクロプレート反応用のMicroplate BCA Protein Assay Kit – Reducing Agent Compatibleのラインアップがあります。 BCA法の化学反応BCA法は、アルカリ条件下でタンパク質によって2価の銅イオン(Cu2+)が1価の銅イオン(Cu+)に還元される原理と、1価の銅イオンが2分子のビシンコニン酸(BCA: Bicinchoninic Acid)と配位結合して紫色に呈色する原理を組み合わせた方法です(図1)。
図1 BCA法の反応スキーム
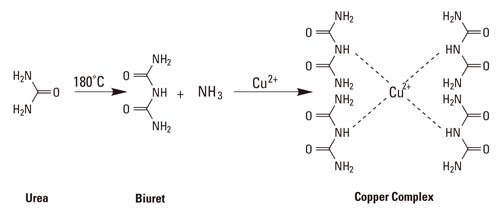
反応の最初のステップではタンパク質と2価の銅イオン(Cu2+)がキレート錯体を形成します。この反応はビューレット反応としてよく知られています。ビューレット反応では酒石酸カリウムナトリウムを含むアルカリ条件下で3アミノ酸以上のペプチドが銅イオンとキレート錯体を形成します。ビューレット反応という呼び名は、もともと有機化合物のビューレット(NH2-CO-NH-CO-NH2)が銅イオンとキレート錯体を形成することに由来します。ビューレット化合物は尿素とともに加熱すると銅と反応して青色の四座配位複合体を形成します(図2)。アミノ酸の数が1つや2つの場合にはビューレット反応は起こりませんが、3アミノ酸以上のペプチドやタンパク質ではビューレット反応が起こり、540 nm付近に吸収のある薄い青色から紫色の複合体を形成します。銅イオン(Cu2+) 1分子あたり4つから6つのペプチド結合と複合体を形成します。
図2 ビューレット反応のスキーム
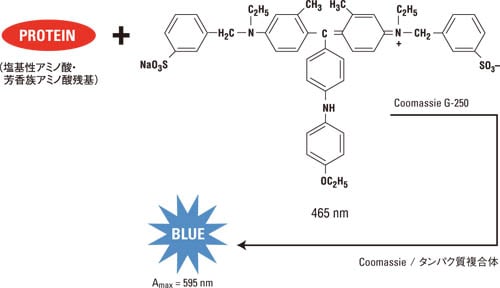
ビューレット反応後に2価の銅イオン(Cu2+)はタンパク質によって1価の銅イオン(Cu+)に還元されます。このCu+ は2分子のBCA試薬と紫色の錯体を形成します。ビューレット反応で形成されるタンパク質と銅イオンの複合体はタンパク質のペプチド結合の数に比例します。銅イオンの還元反応は主にペプチド結合との反応で行われます(ただしシステインまたはシスチン残基、チロシン残基、トリプトファン残基が存在すると還元反応が起こりやすくなります)。またタンパク質の単位質量あたりに存在するペプチド結合の数はほぼ一定であるため、BCA/Cu+ 複合体の発色はタンパク質濃度に比例します。実際BCA法では直線性の高い検量線(r2>0.95)が得られます。BCA/Cu+ 複合体は水溶性で562 nmに吸収をもち、この発色強度を測定することによってタンパク質濃度を見積もることができます。 BCA法のメリット タンパク質間偏差が小さい(タンパク質の種類による発色のばらつきが少ない) 界面活性剤との共存性が高い 検量線の直線性が高い(r2 > 0.95) 室温保存のため、すぐに使用可能 BCA法のデメリット 還元剤や銅イオンのキレート剤により反応が阻害 室温でも発色は少し進むため測定時間に注意が必要 Bradford (Coomassie)法Coomassie Blue色素がタンパク質と結合することが1963年Grothらによって報告され、その後1976年にMarion BradfordらによってCoomassie G-250を用いた総タンパク質定量法が紹介されました。弊社のCoomassie (Bradford) Protein Assay KitやCoomassie Plus (Bradford) Protein Assay Kitは、Marion Bradfordらの方法をベースとして改良を加えた製品です。 Bradford (Coomassie)法の化学反応Coomassie G-250は酸性条件下でタンパク質と結合します。Coomassie色素がタンパク質と結合すると色素は赤茶色(極大吸収波長: 465 nm)から青色(極大吸収波長: 610 nm)に変化します。タンパク質と結合していない時としている時の吸光度の差が最も大きくなるのが595 nm付近であることから、Coomassie色素とタンパク質との複合体の吸光度は一般的に595 nmで測定します(図3)。青色のCoomassie/タンパク質複合体の吸光度は575 nmから615nmの間でも測定が可能です。ただし575 nm や615 nmで測定した場合、吸光度は595 nmで測定する場合に比べて10%程度低くなります。
図3 Bradford (Coomassie)法の反応スキーム
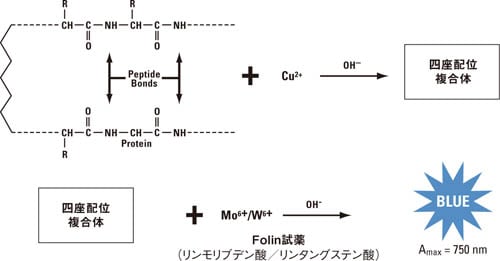
Coomassie色素はタンパク質の塩基性アミノ酸残基(特にアルギニン残基、リジン残基、ヒスチジン残基)やN 末端アミノ酸と結合する他、芳香族アミノ酸残基と疎水結合(またはファンデルワールス結合) することが知られています。タンパク質分子に対するCoomassie色素の結合量は基本的にはタンパク質分子に存在するプラス電荷の数にほぼ比例します。しかしフリーのアミノ酸やペプチドとではCoomassie色素の結合による発色は起こらず、一般的にはペプチド(タンパク質)の分子量は少なくとも3,000 Da以上が必要とされています。この点は低分子のペプチドを無視して総タンパク質量を測定したい場合、例えばビール工場の発酵過程で高分子量タンパク質の総タンパク質量を測定する場合などではメリットになります。 Bradford (Coomassie)法のメリット 反応時間が短く操作が簡便 還元剤や塩との共存性が高い Bradford (Coomassie)法のデメリット 検量線の直線性が低い 界面活性剤により反応が阻害 安定保管には冷蔵保管が必要*(使用前に室温に戻す必要あり) Coomassie色素はガラスや石英のキュベットに吸着※1ヶ月以内であれば室温(18-26℃)で保存が可能 Lowry法Lowry法はOliver H. Lowryらによって1951年に紹介された総タンパク質定量法です。Lowry法は総タンパク質定量に使用されていたビューレット法を改良して感度を飛躍的に高めた方法です。Lowryらの論文はライフサイエンス関連の論文のなかで最も引用数の多い論文のひとつです。弊社のModified Lowry Protein Assay Kitは、Lowryらが使用していた不安定な2つの試薬を1つの安定な試薬に置き換え、より簡便に総タンパク質定量が行えるように改良した製品です。 Modified Lowry Protein Assayの化学反応もともとビューレット法を改良した方法であるため、Modified Lowry Protein Assayの化学反応はBCA法と似ていますが、BCAではなくFolin phenol試薬を利用する点で大きく異なります。Modified Lowry Protein Assayは2つのステップで反応が起こります(図4)。最初のステップではBCA法と同様に、酒石酸塩を含むアルカリ条件下でタンパク質の4つから6つのペプチド結合あたり1分子の銅イオンと青色の四座配位複合体を形成するビューレット反応が起こります。Lowry法では次にFolin phenol試薬を反応液に添加します。Folin phenol試薬が反応液に加えられると青色の発色強度が高くなります。この反応は、Folin試薬(リンモリブデン酸/リンタングステン酸)が四座配位複合体により還元されることで起こると考えられています。このときの青色の発色は室温で約30分間持続します。LowryらやLeglerらによれば、ビューレット反応時の不安定な複合体から安定な複合体への構造変化がこの30分間に起きていると考えられています。 チロシン残基、トリプトファン残基、システイン残基、ヒスチジン残基、アスパラギン残基の5つのアミノ酸残基はリンモリブデン酸/リンタングステン酸複合体の還元に関与するため、ペプチドやタンパク質中にこれらのアミノ酸残基が存在すると発色強度がより高くなります。またチロシンとトリプトファン以外のフリーのアミノ酸では発色は起こりませんが、通常ペプチド結合が2つ以上あれば発色が検出できると言われています。
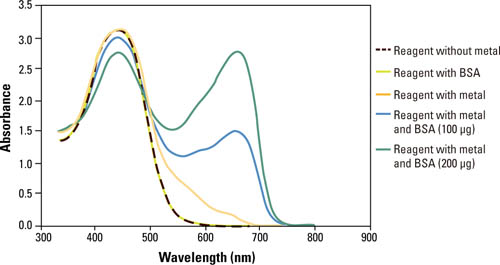
図4 Lowry法の反応スキーム Lowry法のメリット タンパク質間偏差が小さい(タンパク質の種類による発色のばらつきが少ない) Lowry法のデメリット 操作が煩雑 原法では阻害物質が多い(還元剤、界面活性剤、EDTAなどのキレート剤、カリウムイオン、Trisバッファーなど) 安定保管には冷蔵保管が必要*(使用前に室温に戻す必要あり) ※ 1ヶ月以内であれば室温(18-26℃)で保存が可能 Pierce 660 nm Protein Assay法Pierce 660 nm Protein Assay 試薬は、Bradford (Coomassie)法の簡便さと界面活性剤との共存性を兼ね備えた総タンパク質定量試薬です。直線性が高く、ウシ血清アルブミン(BSA)を用いた検量線では25-2,000 µg/mL(マイクロプレートを用いるプロトコルでは50-2,000 µg/mL)とBradford (Coomassie)法よりも広いレンジで測定が可能です。また別途Ionic Detergent Compatibility Reagentを加えることで、他の総タンパク質定量法では困難なLaemmli SDSサンプルバッファーに溶解したサンプルの測定も可能です。 Pierce 660 nm Protein Assay は、独自開発の色素・金属複合体が酸性条件下においてタンパク質と結合することで、赤茶色から緑色(極大吸収波長: 660 nm)に変化する化学反応を利用しています。色素・金属複合体は主にタンパク質の塩基性アミノ酸残基(特にアルギニン残基、リジン残基、ヒスチジン残基)に結合します。またチロシン残基やトリプトファン残基の他、フェニルアラニン残基にも(弱く)結合します。 図5はウシ血清アルブミン(BSA)との結合で変化する色素・金属複合体の吸収スペクトルを表しています。色素のみ(金属なし)の場合は660 nmでの吸収はほとんど見られません。BSAが存在しても金属を添加しなければ色素のみの場合と同様に660 nmでの吸収はほとんど見られませんが、色素・金属複合体を用いると660 nmに吸収がありBSAの濃度に依存して吸光度が高くなることが分かります。
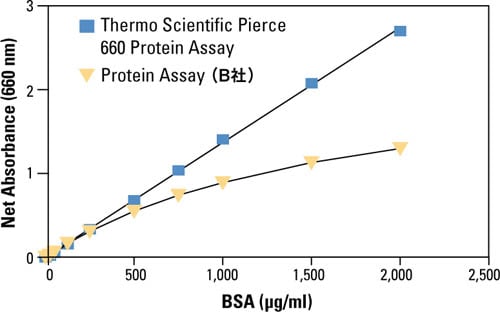
図5 ウシ血清アルブミン(BSA)への結合による色素/金属複合体の吸収スペクトル変化。 Varian Cary spectrophotometerを用いてPierce 660 nm Protein Assay Reagentの吸収スペクトルを測定しました。独自開発の色素/金属複合体がタンパク質と結合すると吸収極大が長波長側へ大きくシフトします。 Pierce 660 nm Protain Assay法の特長 反応時間が短く操作が簡便 検量線の直線性が高い(図6) 還元剤や界面活性剤との共存性が高い 室温保存のため、すぐに使用可能
図6 Pierce 660 nm Protein Assay と Bradford Protein Assay (B社)の直線性比較 それぞれテストチューブを用いるプロトコルでBSAの検量線を作成しました。Pierce 660 nm Protein Assay (青色)では 25-2,000 µg/mL の範囲で直線性が得られたのに対し、Bradford Assay (黄色)では 125-1,000 µg/mLの範囲でのみ直線性を示しました。 最後に 測定サンプルにはタンパク質以外にも多くの分子が含まれており、これらが総タンパク質定量を阻害する場合があります。各総タンパク質定量法においてサンプル中に共存が可能な物質とその濃度については、各製品添付書をご参照ください。また共存可能濃度を超える物質や共存性が不明な物質が含まれる場合は、測定前に除去する必要があります。除去方法としては、透析、ゲルろ過、タンパク質沈殿のいずれかが利用できます。弊社では、タンパク質沈殿法を利用した阻害剤除去とタンパク質定量を行うためのキットとして、Compat-Able Protein Assay Kitsもご用意しています。 これまで比色法をベースとした総タンパク質定量について紹介してきました。比色法以外にはUV法や蛍光法がありますが、それぞれどんな時に有用なのか、ご興味ある方は関連記事をご覧ください。 このブログを読んだ人はこんなブログも読んでいます。 “総”タンパク質定量法のまとめ続き|知っておきたい!UV法や蛍光法を使うのはどんなとき? 透析、ゲルろ過、限外ろ過などサンプル中の夾雑成分の除去方法まとめ|知っておきたい!タンパク質実験あれこれ 第5回 あなたのサンプルは大丈夫?総タンパク質定量の適合性判定方法 【無料ダウンロード】タンパク質解析ワークフローハンドブック効率的なタンパク質抽出からウェスタンブロッティングの解析ツールまで、包括的にソリューションを紹介しております。PDFファイルのダウンロードをご希望の方は、下記ボタンよりお申込みください。 ダウンロード 研究用にのみ使用できます。診断用には使用いただけません。 Share this article FacebookTwitterLinkedinMail 記事へのご意見・ご感想お待ちしています FT-NIR(近赤外分光分析法)を用いた小麦粉のタンパク質、水分、灰分の分析
FT-NIR(近赤外分光分析法)を用いた小麦粉のタンパク質、水分、灰分の分析
小麦粉のタンパク質、水分、灰分などの成分... Read More Blue Native PAGEはなぜ青いのか?
Blue Native PAGEはなぜ青いのか?
Blue Native PAGE。名前だけなら聞いたことがあ... Read More ウェスタンブロッティングの製品選びにもう困らない!第2回:総タンパク質定量キット
ウェスタンブロッティングの製品選びにもう困らない!第2回:総タンパク質定量キット
前回は、ウェスタンブロッティング向けのタ... Read More ウェスタンブロッティングの製品選びにもう困らない!第1回:タンパク質抽出試薬
ウェスタンブロッティングの製品選びにもう困らない!第1回:タンパク質抽出試薬
ウェスタンブロッティングは、特定のタンパ... Read More |
【本文地址】
今日新闻 |
推荐新闻 |