生物制药车间洁净区GMP等级要求及检测设备选型要点 |
您所在的位置:网站首页 › a级洁净区对微生物的要求 › 生物制药车间洁净区GMP等级要求及检测设备选型要点 |
生物制药车间洁净区GMP等级要求及检测设备选型要点
|
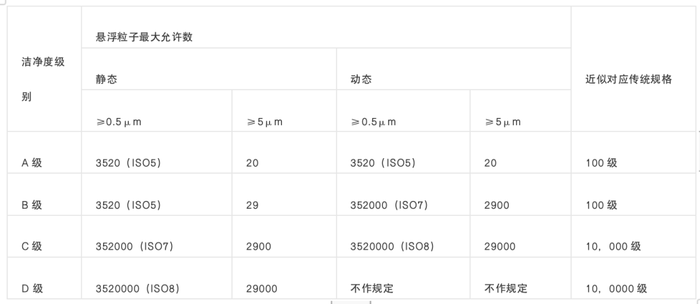
GMP(Good Manufacturing Practice for Drugs),我国制定的名称为《药品质量管理规范》。是一套适用于制药、食品等行业的强制性标准。 这套标准是为了确保生产出的产品(例如食品、药品、医疗器械等)在质量上能满足预定的规格,以保证消费者的安全。 GMP标准涵盖了从原材料选择、生产过程、设备和设施、产品质量控制等生产环节。 它要求制药、食品等生产企业应具备良好的生产设备,合理的生产过程,完善的质量管理和严格的检测系统,确保最终产品质量(包括食品安全卫生)符合法规要求。 中国GMP(2010新修订)规定:为确保无菌药品的质量安全,新版GMP在无菌药品附录中采用了WHO和欧盟最新的A、B、C、D分级标准,对无菌药品生产的洁净度级别提出了具体要求。 中国GMP(2010年修订)
(静态:是指洁净室或洁净区建成且设备就位,但没有人员活动、没有设备运行、没有进行生产操作时的洁净室环境状态。 动态:洁净室或洁净区设施按议定方式运行,且有规定数量的人员按议定方式活动、设备运行和生产操作时的洁净室环境状态。) 一般来说,生物制药车间洁净区会根据GMP标准被分为不同的等级,每个等级都有其对应的洁净度要求。 我们可以根据不同的生产需求选择不同等级的生物制药洁净车间。下面是各类常见的生物制药车间洁净区对GMP洁净度等级的要求: 无菌生产车间:无菌生产车间用于生产无菌药品,如注射剂、眼药水等。在GMP规定下,这类车间的洁净区需要满足最高级别的洁净度等级,通常是GMP的A级。 生物制剂车间:生物制剂车间用于生产生物药品,如抗体药物、疫苗等。这类车间的洁净区洁净度等级要求可能会因为生产过程的不同而不同,但通常至少需要达到GMP的B级。 细胞培养车间:细胞培养车间用于进行细胞培养相关的操作,如细胞分离、细胞培养、细胞冻存等。这类车间的洁净区洁净度等级要求可能会因为操作的不同而不同,但通常至少需要达到GMP的C级。 有害物质处理车间:有害物质处理车间用于处理有害物质,如放射性物质、毒性药品等。这类车间的洁净区洁净度等级要求可能会因为物质的危险性和处理过程的不同而不同,但通常至少需要达到GMP的D级。 此外,中国GMP(2010新修订)还增加了对生产车间在线监测的要求,特别对悬浮粒子,也就是生产环境中的悬浮微粒的静态、动态监测,对浮游菌、沉降菌(生产环境中的微生物)和表面微生物的监测都作出了详细的规定。 而对于车间洁净区的环境监测,我们通常需要使用一些特定的检测设备,例如尘埃粒子计数器、浮游菌采样器等。下面让我们来看看这些设备的选型要点: 尘埃粒子计数器:这是一种能够测量空气中悬浮粒子数量的设备。在选择尘埃粒子计数器时,需要考虑其测量范围、精度、稳定性、是否符合行业标准以及操作的便利性等。 浮游菌采样器:这是一种能够采集空气中浮游菌样本的设备。在选择浮游菌采样器时,需要考虑其采样效率、采样量、操作的便利性以及样本的保存条件等。撰稿人 | 林娟 实验老司机 责任编辑 | 胡静 审核人 | 何发 |
【本文地址】