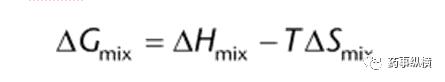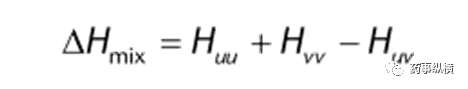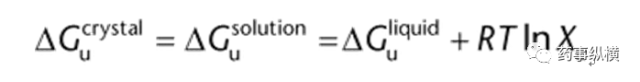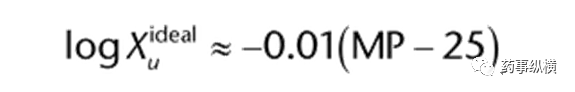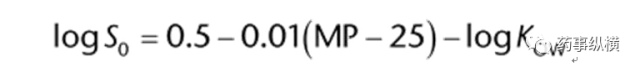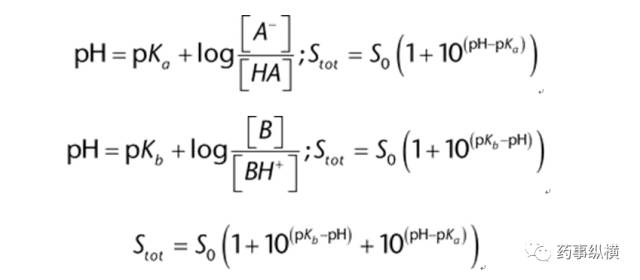溶解度测定搅拌一下就完事了?美国药典通则告诉你正确的测定方法! |
您所在的位置:网站首页 › amp溶解度 › 溶解度测定搅拌一下就完事了?美国药典通则告诉你正确的测定方法! |
溶解度测定搅拌一下就完事了?美国药典通则告诉你正确的测定方法!
|
USP溶解度的测定 溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。物质的溶解度属于物理性质。 一种物质在另一种物质中的溶解度是热力学平衡中两种纯物质之间分子混合程度的量度。饱和溶液的组成,用在指定溶剂中的指定溶质的比例来表示,代表了溶解度的热力学极限。 溶解度可以用质量摩尔浓度、摩尔分数、摩尔比、重量/体积比、重量/重量比等浓度单位表示。 准确测定药物的水溶性对于理解药物制剂的质量控制和药物传递问题是非常重要的, 受药物物理化学性质(例如表面积、颗粒大小、晶型)、介质的性质(例如pH、极性、表面张力、添加表面活性剂、助溶剂、盐)、以及溶解度测定参数的控制(例如温度、时间、搅拌法)等因素的影响。在溶解度测定中控制这些因素是获得准确、可靠的物质平衡溶解度的关键。 本章将首先讨论与溶解度测定有关的概念和方程。理解这些关系是准确评估溶解度的基础。接下来将简要介绍用于评估药物溶解度的典型实验方法。最后,讨论了溶解度测量以获得生物相关的溶解度(人用产品)和物种依赖性溶解度(兽用产品)。 热力学平衡与溶解度 混合吉布斯自由能,ΔGmix,决定了两个化合物混合形成溶液的可能性和程度。
其中, ΔHmix是混合焓,表明混合是吸热还是放热过程; T是热力学温度,开尔文; ΔSmix是混合熵,是纯系统的混乱程度的度量。如果吉布斯自由能的变化是负的,混合将是自发的,当达到平衡时,ΔG等于零。 混合焓ΔHmix,是溶质的焓和溶剂的焓之和与混合物焓间的差值,即:
其中: u是溶质; v是溶剂。如果焓变是负的,混合将放热,反映出附着力作用比内聚力作用更强,有利于混合。一个理想的系统,ΔHmix是零,因为理想的溶质和溶剂之间的相互作用是相同的。因此,对于一个理想的系统:
其中: Xu是以摩尔分数表示的溶质浓度; R是气体常数。当一个结晶固体与饱和溶液处于平衡状态时,固体和饱和溶液的吉布斯自由能是相等的。同样,溶液的吉布斯自由能可以认为是理想溶剂和理想溶质液体混合的结果,因此:
根据Kirchhoff’s定律,不可逆过程的能量等于一系列可逆过程的能量。因此,固体的溶解过程相当于将固体加热到熔点,然后将液体溶质与溶剂混合,最后将溶液冷却下来。 利用Kirchhoff’s定律和上述方程,可以描述为:
Xu是理想溶质在25℃下的摩尔分数,MP是结晶固体的熔点(℃)。这个方程式说明了结晶固体的熔点与摩尔溶解度的关系。熔点较高的晶体化合物具有较高的内聚力,必须克服,才能将其转化为液体,才可与溶剂混合,作为理想的溶质。 水溶解中溶解度的估算方法 Yalkowsky证明了一个相对简单的一般溶解度方程(GSE)可以用于估算化合物在水中的固有溶解度。
其中: S0是内在的溶解度(未解离分子); MP是结晶固体的熔点(℃); KOW是正辛醇-水分配系数,水温度25℃。一般溶解度方程表明,具有较高熔点的化合物以及具有较高亲油性的化合物的水溶性将降低。一般溶解度方程中正辛醇-水分配系数的对数说明了理想溶液和水溶液混合焓的不同。 如果pKa是已知的,一般溶解度方程也可以与Henderson-Hasselbalch方程相结合用来预测离子化合物的溶解度(见影响溶解度和溶解度测定的影响因素,pH值)。 尽管一般溶解度方程很简单,但使用它时需要测量熔点和分配系数(或离子化合物的pKa)。有几种计算机软件用于基于结构的化合物的分配系数和pKa值的估算,但熔点不能。开发来预测水溶液的计算方法依赖于分子的训练集,以寻找与结构(例如,分子量、溶剂可及表面积、可旋转的键的数量等)。这些计算方法的成功往往局限于类似训练集的分子。这些计算方法足以在预筛选合成候选者中提供帮助,但不足以取代实验溶解度测定。 影响溶解度和溶解度测定的因素 1、pH值的影响 离子化的酸和碱的溶解度是pH依赖性的,因为带电部分具有较高的水溶性。Henderson–Hasselbalch方程将溶解度的增加与溶液pH值相对于电离酸或碱的pKa或pKb联系起来。
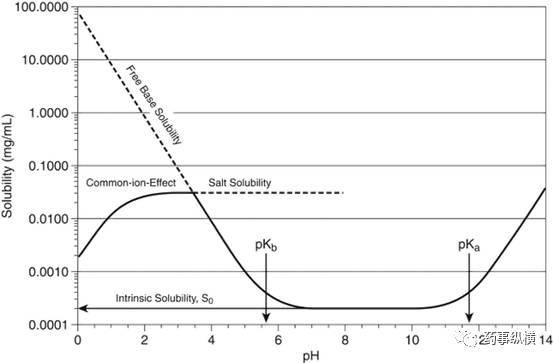
分子在pH值低于5.6和高于11.7时电离,在这两个pH值之间时呈中性。分子没有离子化时,溶解度等于固有溶解度。对于离子化分子,随着pH值的变化,溶解度呈对数增加。成盐后将限制在较低或较高pH值下的溶解度(见图1)。如果用来调节pH值的酸有助于增加盐的反离子,那么同离子效应会随着这个反离子浓度的增加而进一步抑制盐的溶解度(见图1)。如果盐在较高pH值下溶解,最初盐可能会过饱和,但最终将会在这个pH下因为溶解度小而形成沉淀。
图1 pH对离子化合物溶解度的影响。 当分子没有离子化时,溶解度相当于固有溶解度。对于电离分子,随着pH值的变化,溶解度呈对数增加。盐的溶解度限制了低pH值下的溶解度,如果用于调节pH值的酸对盐的反离子有一定贡献,那么,同离子效应会随着这个反离子浓度的增加而抑制盐的溶解度(图中pH值 |
【本文地址】
今日新闻 |
推荐新闻 |