指南翻译┋生理药动学PBPK分析在生物药剂学的应用 |
您所在的位置:网站首页 › PBPK模型应用医院 › 指南翻译┋生理药动学PBPK分析在生物药剂学的应用 |
指南翻译┋生理药动学PBPK分析在生物药剂学的应用
|
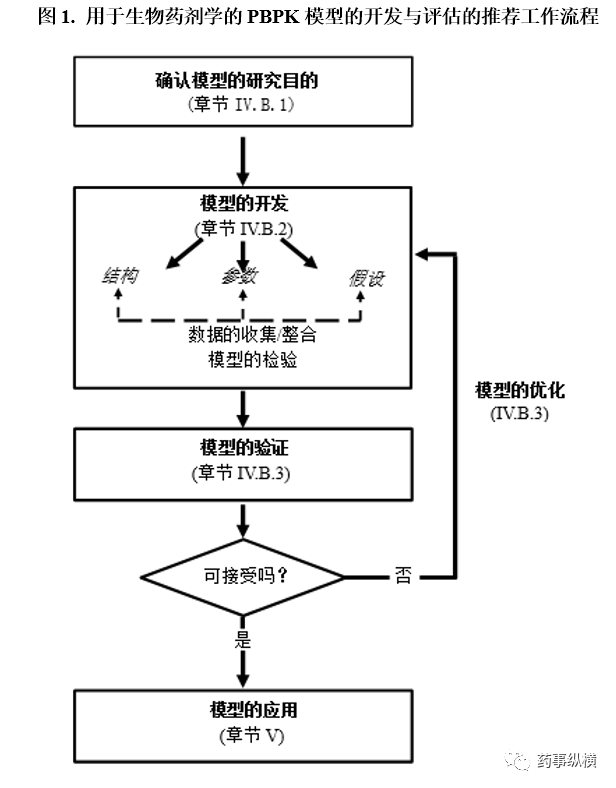
III. PBPK建模在生物药剂学应用中的实施 PBPK建模可用于药品的开发、生产工艺的变更和质量控制。一种可行的方法是将药品的体外试验(例如具有生物预测性的溶出方法)与PBPK模型相结合,其中将体外溶出数据输入到PBPK模型中,进行吸收的预测(Heimbach 等人2019)。因此,溶出测试是建模时关键的输入参数,因为它可以探测到药品在体内释放的程度和速率。 在生物药剂学中使用PBPK分析的目的,是将溶出/具有生物预测力的溶出测试或其他体外测试数据整合输入到PBPK模型中,该策略是为了定量描述(或表征)制剂处方的变量与人体的潜在相互作用,及这些变量对药物体内暴露的影响。这种建模方法应包括与吸收过程相关的作用机制,例如药物在胃肠道中的代谢(如适用),药物涉及的转运机制,接着结合药品的质量属性预测药物在体循环的暴露。 通过定义这些作用机制的要素,用于生物药剂学的PBPK建模可预测CMA,CPP和CQA的变化对药物体内暴露的影响,通过IVIVC或体内-体外关系IVIVR, 与虚拟BE的结合可构建药品的安全空间。安全空间(Abend 2018)通过体外标准(即溶出度,或其他适用的相关药物质量属性)定义界定的边界,在边界内的药物变量被预期是生物等效性的。并非最佳选择,但存在可能:药物变量如在安全空间所界定的边界内,则被预期与关键临床批次是生物等效性的(例如,调释制剂MR具有合适的额外支持数据)8。通过构建安全空间还可以减少支持法规监管评估所要求的体内数据9。尽管新药和仿制药都可以使用安全空间的方法,但构建仿制药的安全空间时,必须通过一系列的虚拟溶出曲线考察不同目标制剂彼此之间和参比制剂或目标药品是否具有生物等效性(例如通过虚拟BE分析)。而且,虚拟溶出曲线的范围应包含目标溶出曲线(即生物批或关键临床批)。 为确保药品质量,是否采用生物药剂学的PBPK分析,应通过基于风险的方法(如Kuemmel等人2020)慎重衡量以下几个因素:(1)药物在体内的溶出,是否是吸收的限速步骤(相对于渗透性);(2)用于目标模型开发,验证,确认的体外和体内数据的收集10;(3)药品制剂处方的复杂程度。例如,针对API是高溶解的速释制剂IR的主要生产工艺变更,在生物药剂学中使用PBPK分析,通常结果并不理想11。 Ⅳ. 用于生物药剂学的PBPK模型的开发与评估 A. 通用的策略 推荐用于口服制剂的生物药剂学PBPK模型开发,评价,应用的通用流程如图1所示,将在本章节和章节V“PBPK建模在生物药剂学的应用-支持药品质量”进行详细介绍(Zhang 等人2011)。 提交给FDA的申报材料中,如有使用生物药剂学PBPK模型开展建模与模拟的研究,则应在药品电子通用技术文档eCTD模块的5.3.1.3章节包含该完整的研究报告12。 模型开发所需的数据,包括但不限于: 药物自身性质的数据:API的理化性质;制剂处方的属性;药品的释放机制;药品的ADME性质;临床相关的数据(如BA / BE,或其他PK数据)。 生理学数据:如有适用的胃肠道和其他器官和/或组织的人体数据(即解剖结构和生理参数)。用于模型开发和验证的体内临床研究数据(例如,受试药品或受试制剂的信息,给药方案,临床研究受试群体)。 用于模型开发和验证的体内临床研究数据(例如,受试药品或受试制剂的信息,给药方案,临床研究受试群体)。
B. 通用的考虑因素 以下内容阐述了用于支持药品质量的模型开发和评价的常规注意事项。 1. 模型的研究目的 在研究报告中应明晰地描述用于生物药剂学的PBPK建模要解决的特定药品质量大问题或小问题。申办方应提供特定质量问题是怎样影响药品体内PK性能的分析报告,说明进行建模与模拟的理由,并制定降低体内PK变化风险的控制策略。分析报告里还应说明建模结果的置信度,模型的置信度是建立在用于检验和/或验证模型的数据(单独用于测试模型的数据)和其他影响因素的(例如模型的应用范围,治疗的适应症,药物的治疗窗)。FDA将根据模型的依据是否充分进行模型的具体评价,包括模型预期的目的是什么,用于模型检验和验证的数据是否充足。 2. 模型的开发 模型的开发应包括以下三个基本要素。 a. 模型结构 模型的结构应提供药物口服吸收的机制性架构,该架构可以代表药物在体内的吸收过程,并将影响药物溶出和吸收的相关药品质量属性也纳入模型中。吸收模型的构建应考虑到模型的预期目的,以及影响药物溶出和吸收的多个因素及它们之间的相互作用。这些因素包括但不限于:原料药的理化性质;制剂处方/工艺特性;药物的释放机制;药物在体内的溶出过程;过饱和和沉淀过程;药物吸收的位置和持续时间;药物的渗透和转运途径;胃肠道生理对吸收的影响。最后,模型的构建还应考虑能获得的用于证明模型结构合理性的支持数据和相关知识。申办方还应记录将质量属性(例如溶出度)和其他因素整合到模型所采用的方法。 由于该模型的考察重点是药物在体内的溶出和吸收,因此,合适的方法是将机制性吸收模型与简化的处置模型(例如采用经典的房室PK模型或减少了组织/器官房室的PBPK模型)相结合,从而预测药物经口服吸收后的体循环暴露量。如某些因素不影响充分描述控制药物生物利用度的过程,则建议应进行简化。 当药物的处置呈现复杂性时(例如非线性PK,清除途径呈现饱和),建议使用另一种方法,例如,将代谢酶动力学纳入到处置模型中。对初始模型结构的任何修改都应有充分的理由说明(例如,通过全面的敏感性分析,和/或有合适的证据明确地表明所关注指标的重要性,说明需要添加其他因素到模型中)。 b. 模型假设 应明确地阐述模型结构和参数的基本假设(例如,对药物崩解,溶出,沉淀,降解,转运,首过效应,分布,清除率的假设)。如有相应的信息,应使用支持性的信息和数据来科学地证明这些假设。同时,还应描述这些假设对模型结构和/或参数的影响。 c. 模型的参数 应清晰地阐述并科学地证明将药品质量数据整合到模型的方法,以及模型输入参数和参数值的选择。选择和评价以下三类模型输入参数时,应考察它们的属性和这些参数是否会影响药物的体内溶出和吸收,这三类参数是:关键物料属性CMA(如API的理化性质和辅料的等级),关键工艺参数CPP(如压片的压力),关键质量属性CQA(如硬度,崩解,体外溶出)。 3. 模型的验证与优化 一个模型的预测性能应根据其预期目的进行验证。根据临床风险和预期目的,进行模型验证的数据量和类型可能会有所不同。建议使用未用于模型开发的独立数据集(测试集)来评估模拟的预测性能。一般而言,为了解决制剂开发和药品质量问题,应建立体外试验(例如体外释放/溶出)和体内PK结果之间的明确序列对应关系,来证明模型的输入对预测受试药品的PK性能的影响依据的充分性。 为了提高模型的置信度,FDA强烈建议申办方采用生物利用度BA不可接受和可接受(与目标和/或参比制剂相比)的不同批次的PK数据来说明模型的预测性能。在这种情况下,根据BE判定标准,当受试制剂与参比制剂的C max和AUC几何均值比的90%置信区间未落在80%到125%的范围内时,将认为生物利用度BA是不可接受的。模型验证的可接受标准应事先确定,并且该标准需对应特定的应用。例如,用于支持生物豁免的机制性IVIVC模型的模拟验证可接受标准应符合《行业指导原则-口服缓释制剂体内外相关性IVIVC的建立、评估及应用》制定的标准。 为了证明模型的预测性能,申办方应提供预测和试验观测的药时曲线(例如血浆的)和PK参数估算(例如C max, T max, AUC)图和数字的对比,及这些估算值的统计分析(例如置信区间)。出现的任何模型预测与临床PK试验观测结果之间的重大偏差(例如不符合预先设定的模型可接受标准)将由FDA进行评估。 当模型需要进行调整或优化时,FDA建议对模型的结构和参数进行不确定度分析。此类分析可以通过重新评估模型的假设和/或参数敏感性分析来完成。模型结构和/或参数的修改应有明确的阐述和科学的证明。进行模型参数优化时,除了科学依据和基本原理外,申办方还应提供参数选定的初始值和范围,估算的方法和优化的算法,以及用于优化的体外和体内数据。 Ⅴ. PBPK建模在生物药剂学的应用-支持药品质量 用于生物药剂学的PBPK建模,因提供了可预测药物体内PK的能力,在制药行业中得到了广泛的使用,包括制剂的开发,具有生物预测力溶出方法的开发,具有临床相关性的药品质量标准的制定,质量风险评估,药品生命周期管理。用于生物药剂学的PBPK建模,可以减少首次获批过程中BA/BE体内试验研究开展的数量(例如因制剂处方和/或生产工艺变更需开展的体内试验),以及支持药品扩大生产和上市后的变更(SUPAC)。监管中,用于生物药剂学的PBPK模型支持药品质量的主要用途如下。对于本指导原则中未讨论的情况,鼓励申办方联系FDA。 A. 开发具有临床相关性的溶出标准(方法和可接受标准) 1. 辅助具有生物预测力的溶出方法的开发 尽管具有生物相关性介质和合适的溶出测试条件创建基于生理的溶出方法的使用已取得一定的进展(Kostewicz等人2014b),但在使用体外溶出数据定量预测药物的吸收仍面临不小的挑战。具有生物预测力的溶出方法可生成相应的溶出曲线,该溶出曲线可用于预测固体制剂口服给药后体循环的体内暴露量(Suarez-Sharp等人2018)。这时,溶出数据可有效地评估药品变量对临床相关效应的影响,从而可作为替代体内评估的方法,因此简化了药品的开发过程。 FDA鼓励在药品开发的早期阶段就开发具有生物预测力的溶出方法,特别是针对溶出为吸收限速步骤的药品,例如调释制剂MR和API系难溶性的速释制剂IR。 用于生物药剂学的PBPK模型是描述药物吸收复杂机制的平台,可以估算药品的体内溶出曲线,这是通过模拟药物在胃肠道内的吸收过程而获得的。尽管预测的体内溶出曲线可以作为参考,但更重要地是了解API的理化性质和药品的质量属性,以及这些性质对体内溶出的潜在影响,这对具有生物预测力/具有临床相关性的溶出方法的开发至关重要。API的关键理化性质和药品质量属性包括但不限于:(1)在生理pH范围内的水介质(例如pH 1-6.8)和/或具有生物相关性的介质(例如模拟胃液,模拟空腹或餐后状态下的肠液)中的溶解度;(2)对应的饱和,过饱和,沉淀性质;(3)释放机制;(4)在生理pH范围内,不同pH介质下的体外溶出特征。 通过探索新的溶出方法(例如,介质,设备和流体动力学),可开发出可预测药品体内溶出曲线的体外溶出方法。鼓励使用具有生物相关性的溶出方法作为具有生物预测力溶出方法开发的起点。 在建立质量控制QC的溶出测试方法时,鼓励实施具有生物预测力的溶出方法。如果确定具有生物预测力的溶出方法不适合用于常规检测(例如方法过于复杂),则可以选择其他溶出方法作为QC主要的溶出测试方法,而将具有生物预测力的溶出方法保留为必要时协助质量评估的替代测试方法。例如,在支持CMC变更时,可以使用具有生物预测力的溶出方法替代首位的QC溶出测试方法,以此保障药品维持预期目标的体内性能。 2. 支持具有临床相关性的溶出可接受标准 具有临床相关性的溶出可接受标准,是指可以识别和拒绝受试药品批与指关键临床批是否生物等效的指标(Abend等人2018)。这通常指的是溶出方法可接受标准的设置,以最大程度地降低不同批次出现临床疗效差异的可能性。具有临床相关性的溶出可接受标准可以设置得比关键临床批次的平均溶出数据范围更宽些(例如,对于缓释制剂ER,其变异范围超过±10%)13。 因为用于生物药剂学的PBPK建模可将体外溶出和体内PK性能关联起来,因此可以支持建立具有临床相关性的溶出可接受标准。将代表目标限度和/或溶出速率的体外溶出曲线纳入生物药剂学PBPK模型中(例如用于虚拟BE研究),其PK预测结果可以用于证明计划的具有临床相关性的可接受标准的合理性。该方法应进行这两种PK预测结果的比较,第一种是基于代表目标溶出限度的体外溶出曲线预测得到的PK结果,第二种是基于关键临床批次的体外溶出曲线预测得到的PK结果(作为参比)。 申办方在进行虚拟BE研究时应考虑以下因素:(1)受试者个体内和个体间变异的PK参数估算(例如C max和AUC)应能代表试验观测的受试者个体内和个体间变异;(2)虚拟BE试验的受试者人数应合理,且应与体内BE研究试验的受试者数量相当;(3)用于估评估开展BE试验可能性的虚拟BE试验的数量应当合理。 如果分析结果符合BE的可接受标准,则计划的溶出可接受标准可认为具有临床相关性。对于缓释ER制剂,最好设置为具有临床相关性的溶出可接受标准,并使所有批次的溶出曲线都在生物等效性所要求标准的上限和下限范围内,以便每批之间是生物等效的。并非最佳选择的是,溶出曲线在溶出上限和下限的批次应该与临床/BA批是生物等效的,或与适当的参比制剂是生物等效的,但批次之间不一定彼此是生物等效的14。对于仿制药,预测的目标PK对应的溶出上限和下限应能确保不同批次之间药品的变量是生物等效的,并与参比制剂也是生物等效的。 还可以使用经验证的生物药剂学PBPK模型进行参数敏感性分析(PSA),从而评价溶出速率的变化对体循环暴露的影响,以帮助计划的具有临床相关性的溶出可接受标准的制定。 B. 建立具有临床相关性的药品质量标准(除溶出方法外) 质量源于设计QbD是一种为提高药品质量,用于药品开发和生产的系统方法,该方法可以更多地考虑患者预期的药品用法;然而,在QbD实施中,为原料药、辅料、生产工艺物料、最终成品药建立具有临床相关性的标准通常面临很多挑战。目前药品质量的检测或控制很大程度依靠对临床批、开发批、注册批的体外检测/性能检测(包括体外溶出)。尽管单独的临床数据一般不足以引导合适的药品标准制定,但在药品开发过程中收集该药品的临床药理和生物药剂学信息,可提升用于生物药剂学的PBPK模型的预测性能。这样的模型可以帮助建立所需的体外-体内联系,而这是建立具有临床相关性的药品质量属性的要素。 如果将质量属性和生产工艺参数直接或间接纳入模型,则可以评估这些质量属性和参数对体内溶出和吸收的影响。质量属性可以包括:(1)原料药的质量属性(例如粒径分布,物理的形态,多晶型的形式);(2)辅料的质量属性(例如控制释放速率的辅料的类型和/或水平);(3)生产工艺的质量属性(例如颗粒的粒径,包衣增重);(4)成品药品的属性(例如崩解)。生产工艺参数包括但不限于包衣的参数和压缩力。当无法通过质量属性和工艺参数作为模型输入参数考察对体内PK的影响时,可通过在模型中输入具有生物预测力的溶出曲线考察相关的影响。 具有临床相关性的质量属性标准的设置,与具有临床相关性的溶出可接受标准相似,可通过模型的预测确保受试药品的批次与关键临床批/BA批(请参阅V.A.2章节,支持具有临床相关性的溶出可接受标准)或与仿制药参比制剂,在生物等效的质量标准限度范围内。 C. 药品上市前和上市后变更的药品质量风险评估和基于风险的生物豁免 申办方可以将用于生物药剂学的PBPK分析,作为在药品开发和药品生命周期中进行质量风险评估和管理的高级工具。具体而言,通过建模的方法可以对质量属性如何影响药品的临床疗效提供更深的理解,从而有助于风险评估作为制剂处方和工艺开发,控制策略中的一部分,同理也可以作为药品上市后变更的风险评估方法。 药品上市前和上市后阶段,用于生物药剂学的PBPK分析包括: 药品上市前阶段 药品上市前阶段 ‒建立具有临床相关性的生产工艺设计空间和控制策略,降低药品质量风险,从而支持以患者为中心的药品开发 ‒桥接临床批到上市商业化药品的CMC变更,例如在药品开发过程中发生的制剂处方、生产工艺、生产场地变更 药品上市后阶段 药品上市后阶段 ‒根据SUPAC和/或ICH行业指导原则草案《Q12 药品生命周期管理的技术和法规考虑:核心指导原则》和《Q12 药品生命周期管理的技术和法规考虑:附录》(2017年11月)关于药品上市后发生的制剂处方、生产工艺、生产场地变更15,开展风险评估和风险分类 支持药品上市后变更的生物豁免 支持药品上市后变更的生物豁免 可以使用V.A章节阐述的相同方法进行风险评估,并使用V.B章节的方法制定具有临床相关性的药品质量标准。在这方面,模型预测或PSA分析结果可用于支持高影响力的CMC变更,否则可能需要按照行业指导原则开展体内BE研究《SUPAC-IR指导原则-速释口服固体制剂放大生产和批准后变更:化学、生产和控制,体外溶出试验、体内生物等效性文件》和《SUPAC-MR指导原则-调释口服固体制剂放大生产和批准后变更:化学、生产和控制,体外溶出试验、体内生物等效性文件》(1997年9月)。在考量风险评估的结果,计划变更的影响等级,及申办方提交的整体信息后,FDA可能会批准由用于生物药剂学的PBPK模型支持的生物豁免申请。 术语词汇表 生物药剂学:药物的理化性质,剂型因素,制剂处方因素,药物发挥作用开始、持续时间和强度的相关研究。 具有生物预测力的溶出方法:能够预测体内PK曲线的体外溶出条件。一般通过经典或机制性的IVIVC获得。 具有生物相关性的溶出方法:模拟接近生物体相关的流体和生理环境的溶出条件(例如溶出介质,流体动力学) 具有临床相关性的溶出标准: 在溶出试验中将影响临床效应的变量纳入到标准制定中,确保不同药品保持一致的安全性和有效性。 关键工艺参数(CPP): 对关键质量属性CQA有影响的工艺参数变量,需对这些参数进行监控或控制,以确保工艺可生产出所需的质量16。 关键质量属性(CQA): 为确保药品目标质量,应控制在合适的限度、范围、或分布内的物理、化学、生物或微生物的性质或特性17。CQA通常与原料药、辅料、中间体(工艺过程中的物料)和制剂相关。 设计空间: 已被证明可保证药品质量的多维度和相互作用的输入变量(例如物料属性)和工艺参数。在设计空间内的生产被视为无变更。而超出设计空间的生产被视为有变更,且通常需要开展药品上市后变更流程。设计空间的变量和参数由申办方提出,并提交给法规监管机构评估和审批18。 体外/体内相关性(IVIVC):一种有预测力的数学模型,用于描述缓释制剂ER的体外性质(通常是药物溶出或释放的速率或程度)和体内响应(例如药物在血浆中浓度或药物的吸收量)之间的关系19。 体外-体内关系IVIVR: 药物体内相关响应与体外释放曲线之间的定性等级排序关系。 参数敏感性分析(PSA): 在其他参数不变的情况下,针对某一目标参数的系列分析,用不同的假设来探索从主估计量到潜在建模假设的偏差及数据上下限度的稳健性20。 生理药代动力学(PBPK)分析:一种结合生理学、群体和药物特性的模型和模拟,用于机制性地描述药品的PK和/或药效学行为的分析21。 风险评估:在风险管理过程中组织信息以支持风险决策的系统过程。它包括查明危害,及对这些危害暴露进行分析和评价22。 安全空间:由体外溶出或其他药品相关的质量属性标准确定边界,如药品的变量在边界内,则被预计为是生物等效的。参考文献 略 PDF版译文索取 方式二:点击左下方【阅读原文】 如无法正常获取译文,可联系: 微信客服:ipharmogo(小蘑菇) 药事纵横投稿须知:稿费已上调,欢迎投稿 返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |