ROR1–HER3–lncRNA信号轴通过Hippo–YAP通路对骨转移调控机制的研究 |
您所在的位置:网站首页 › KO3结构 › ROR1–HER3–lncRNA信号轴通过Hippo–YAP通路对骨转移调控机制的研究 |
ROR1–HER3–lncRNA信号轴通过Hippo–YAP通路对骨转移调控机制的研究
|
Figure1. 探索ROR1的功能表征和YAP1的相关性,通过实验确定了ROR1促进乳腺癌细胞在骨内的定植和生长以及ROR1在癌细胞诱导的破骨细胞分化中的作用。
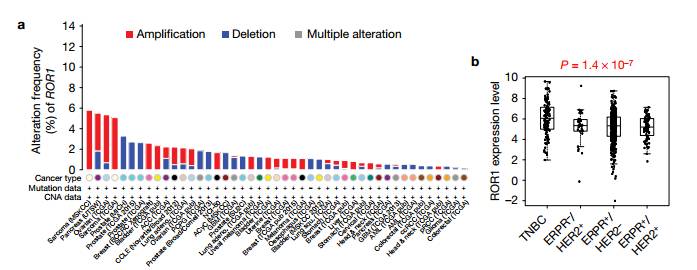
a. 在肉瘤、卵巢癌、胰腺癌、乳腺癌和肺癌中,有2%到6%的患者扩增了ROR1位点.在乳腺癌中,尤其在三阴性乳腺癌中,ROR1位点被放大。 b. 在TNBC中,与非TNBC亚型相比,ROR1的表达上调更显著。
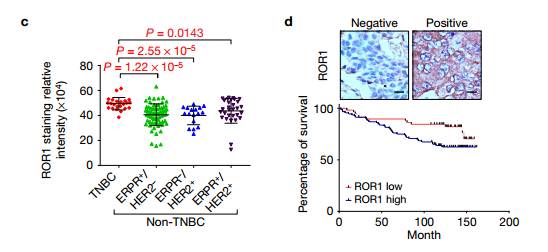
c. d.乳腺癌组织微阵列(TMAs)的免疫组织化学(IHC)染色显示高水平的ROR1与TNBC亚型相关,并且生存差.ROR1高低时,乳腺癌患者的生存分析
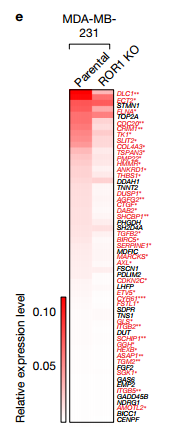
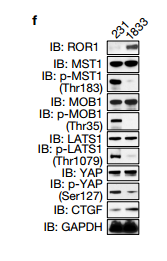
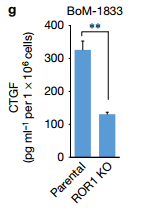
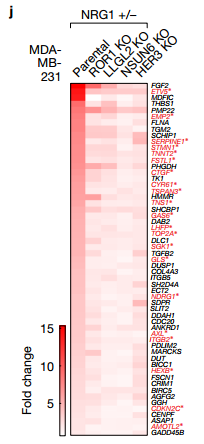
e.此热图代表亲本和ROR1 KO细胞中57个YAP1靶基因的颜色编码的表达水平。作者检查了ROR1 KO细胞中YAP1调节的基因的表达,发现57个YAP1调节基因中的有37个表达因ROR1的KO而下调 f.IB检测ROR1 KO的mda - mb - 231细胞和BoM-1833细胞中相关蛋白的表达水平 g.CTGF ELISA检测在亲本和ROR1 KO 的BoM-1833细胞中的CTGF的水平 ROR1蛋白水平在BoM-1833细胞中上调,而ROR1 KO降低CTGF生产接下来作者确定了ROR1在癌细胞诱导的破骨细胞分化中的作用。
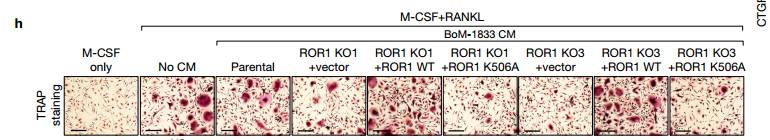
h.M-CSF , M-CSFCRANKL ,无rankl含亲代CM,ROR1 KO1的CM,ROR1 KO1 加ROR1 WT的CM,ROR1 KO1 加K506A的CM,ROR1 KO3的CM,ROR1 KO3 加ROR1 WT的CM,ROR1 KO3 加K506A的CM, 这种受损的破骨细胞分化由来自表达WT ROR1而不是K506A突变体的ROR1 KO细胞的CM拯救。
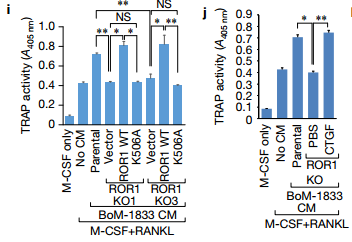
ij.H分化图的量化分析。 实验发现破骨细胞前体分化成成熟的破骨细胞用条件培养基(CM)从亲本刺激而不是ROR1 KO BoM-1833细胞,并且这种受损的破骨细胞分化由来自表达WT ROR1而不是K506A突变体的ROR1 KO细胞的CM拯救。
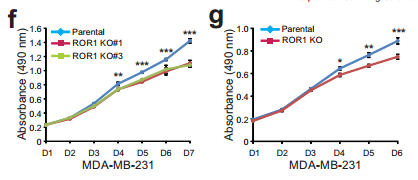
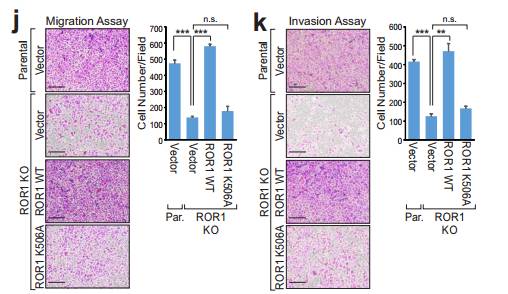
补充fgjk 作者通过敲除ROR1对乳腺癌231细胞增殖 转移 和侵袭的影响。
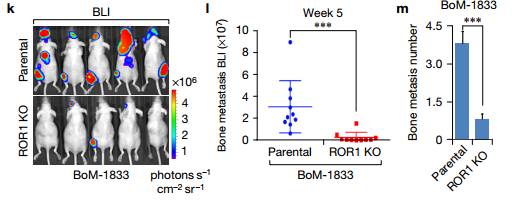
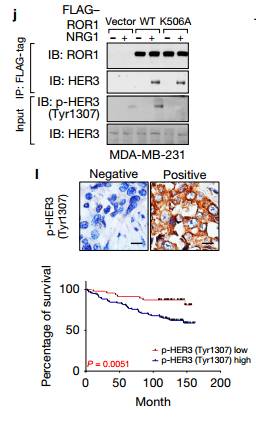
kim.接下来作者为确定ROR1在乳腺癌骨转移中的作用。将含有稳定表达的荧光素酶的BoM-1833细胞通过心内注射接种到裸鼠,并且通过生物发光成像(BLI)每周监测转移进展,及其量化分析。ROR1 KO使小鼠四肢的肿瘤负荷大大降低,当ROR1被敲除时,骨转移病灶数量也减少,这些数据表明ROR1通过调节Hippo-YAP途径促进骨内乳腺癌细胞的定殖和生长的重要作用。 Figure2. Figure2.作者为了鉴定ROR1的潜在底物或调节剂,发现ROR1以一种独立于ErbB的方式在Tyr1307位点处使HER3磷酸化,且HER3 Tyr1307位点处的磷酸化与ROR1呈正相关。
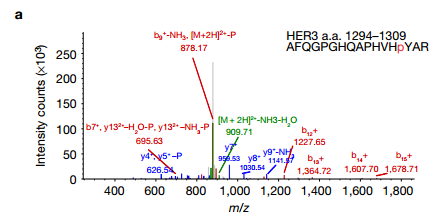
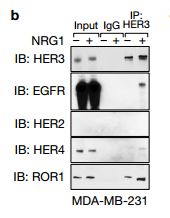
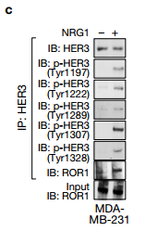
a. 作者通过二级质谱发现HER3一个与ROR1相关的新位点—Tyr1307位点。 b. 在NRG1刺激之后HER3与EGFR,HER4和ROR1相关。 c. NRG1激活已知的HER3酪氨酸位点处的磷酸化,也包括新发现的Tyr1307位点。 作者假设ROR1和HER3可能形成异源二聚体,并且发现在NRG1刺激之后HER3与EGFR,HER4和ROR1相关.NRG1触发先前已知的HER3酪氨酸位点处的磷酸化
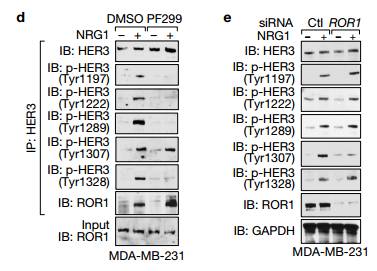
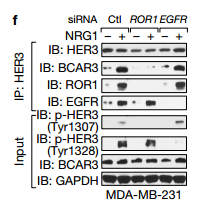
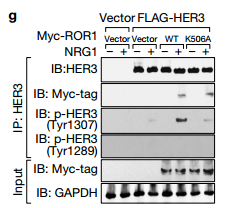
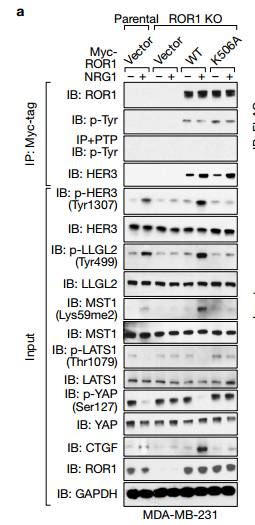
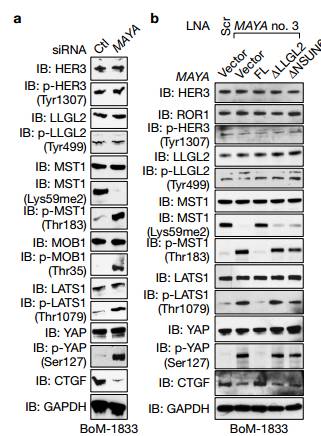
d.e.IB检测用SiRNA沉默的231细胞中的相关蛋白,d可以看出用PF299(EGFR抑制剂)作用后四个已知的HER的位点磷酸化被抑制了,而新发现的Tyr1307位点没有被抑制,e图可以看处与ctl相比较沉默ROR1时,Tyr1307位点被抑制而不影响其他四个位点,说明ROR1激活HER3的磷酸化是通过Tyr1307位点。 f.可以看出在NRG的激活下对照组与沉默ROR1相比较BCAR3、ROR1、HeR3的Tyr1307位点可以被拉下,沉默EGFR时HeR3的Tyr1307位点也可以被拉下,说明沉默EGFR不影响HER3的Ty1307位点的磷酸化,ROR1的作用独立于EGFR,作用于HER3的Ty1307位点。 g.可以看出以两个Vector为对比,WT和突变体K506A在NRG1的刺激下,ROR1中HER3的Ty1307位点可以被拉下。
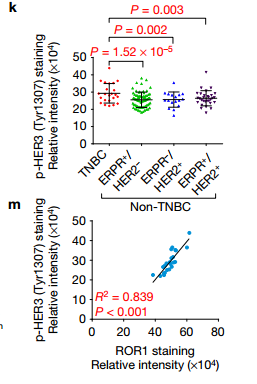
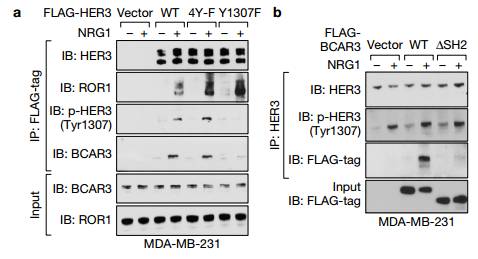
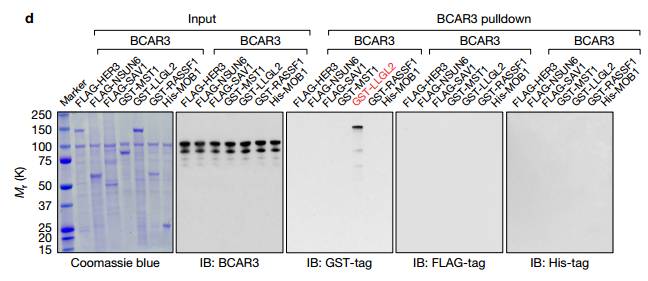
h.i.GST下拉实验IB检测看出HER3的Ty1307位点磷酸化在胞内而不是胞外 j.在乳腺癌细231胞中,ROR1 K506A突变体的表达消除了NRG1刺激后HER3中Tyr1307位点的磷酸化 L.p-HER3的IHC染色。p-HER3(Tyr1307)高低在乳腺癌患者的Kaplan-Meier生存分析 K.在TNBC和其三个亚型p-HER3的IHC染色的量化分析。TNBC恶性程度最高 M.p-HER3的IHC染色和ROR1的IHC染色相关性分析 Figure3. ROR1-HER3和Hippo-YAP途径之间的联系,受体酪氨酸激酶的磷酸化触发募集含有SH2结构域的蛋白质以介导下游信号传导。为了测试这一点,作者将HER3 Tyr1307突变为苯丙氨酸(Y1307F),并且通过MS鉴定了含有SH2结构域的蛋白质BCAR3。
A. IP后接IB检测在NRG1刺激且对应质粒转染后的231细胞蛋白,观察ROR1和HER3,p-HER3(Tyr1307)磷酸化和BCAR3在MDA-MB-231细胞中的相互作用。说明用NRG1处理后HER3 Y1307F突变体(而不是4Y-F突变体)的表达消除了NRG1刺激后的p-HER3和BCAR3相互作用。 B. BCAR3的SH2结构域的缺失取消了HER3-BCAR3的相互作用,但是对p-HER3(Tyr1307)没有影响。说明HER3-BCAR3的相互作用是通过BCAR3的SH2结构域来影响p-HER3(Tyr1307)。
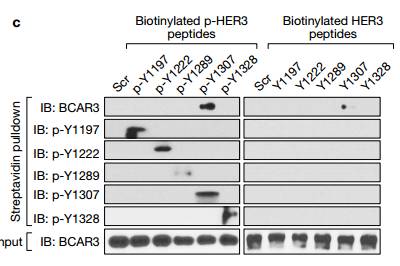
C. 抗生物素蛋白链菌素下拉实验显示含有pTyr1307但不包含其他p-Tyr残基的HER3肽与BCAR3有强烈的相互作用。 D. 重组蛋白质下拉测定表明,是BCAR3直接结合LLGL2,但不是由MS鉴定的其他蛋白质结合BCAR3。
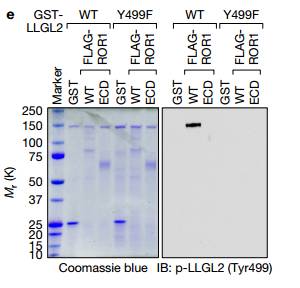
E. 用FLAG标记的WT ROR1或胞外域进行体外磷酸化测定(ECD)和GST标记的LLGL2。(图3f)。 说明ROR1是LLGL2(Tyr499)磷酸化的最合理的候选者。
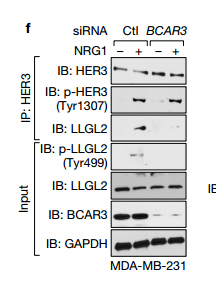
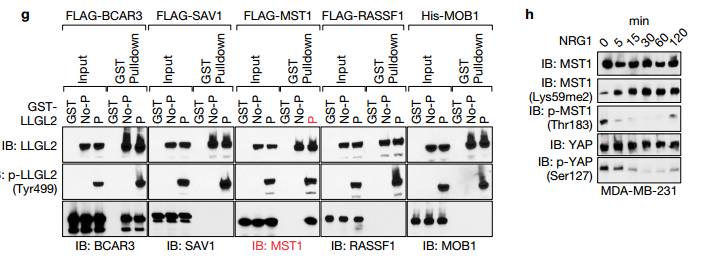
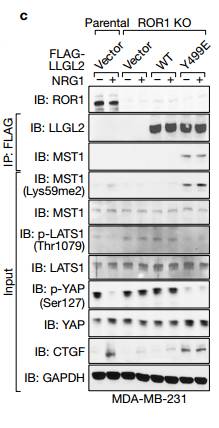
F与对照相比沉默BCAR3时,LLGL2没有被拉下。敲除BCAR3消除了HER3和LLGL2以及p-LLGL2(Tyr499)之间的相互作用。ef说明LLGL2与BCAR3相结合,但是仅P-LLGL2(Tyr499)结合MST1。
g未磷酸化的或Tyr499磷酸化的LLGL2与指示的重组蛋白进行GST下拉试验,说明P- LLGL2的可以将MST1拉下,说明磷酸化的LLGL2与MST1有相互作用。 h MST1甲基化状态与MST1(Thr183)磷酸化和YAP1(Ser127)磷酸化负相关 Figure4.
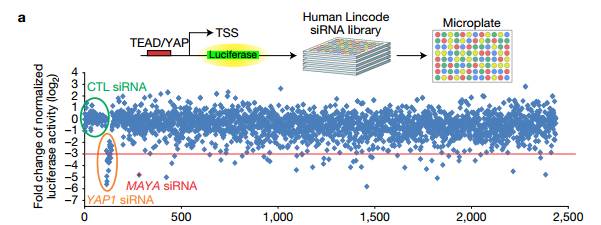
A.在MCF-7细胞中筛选人Lincode siRNA文库。 红线定义了荧光素酶活性的八倍变化的阈值,随后测定相对的YAP1活性。 作者在log2≤-3(红线)处设置了一个阈值来精确定位可能需要YAP1依赖性转录的40个lncRN)
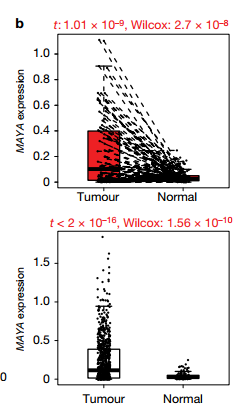
b癌症基因组图谱(TCGA)数据库挖掘显示,MAYA表达在乳腺癌中与正常组织相比表达上调。
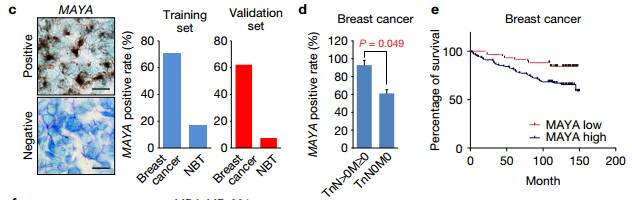
c在乳腺癌和正常组织中MAYA的IHC染色,及其量化数据。 d在乳腺癌转移和非转移两者中的MAYA表达差异。 E MAYA高低在乳腺癌患者的Kaplan-Meier生存分析。
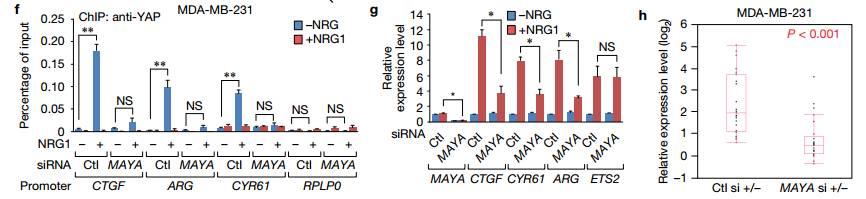
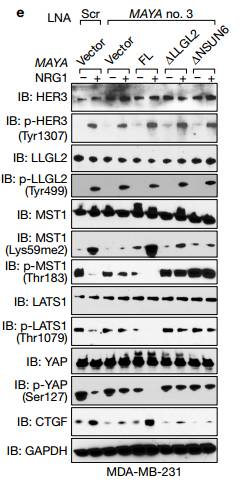
fgh 接下来作者测试了在这个特定的信号环境下是否需要MAYA激活YAP1?实验发现在NRG1刺激下MAYA消耗显著损害了MAYA使YAP1激活的相应启动子,以及这些启动子所占据的基因表达量。
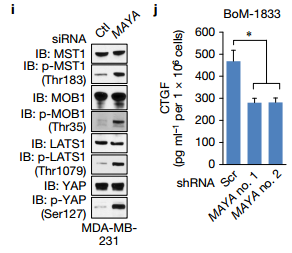
I. MAYA沉默后,MST1(Thr183),MOB1(Thr35),LATS1(Thr1079)和YAP(Ser127)的磷酸化增加。 J. MAYAko显着减少了BoM-1833细胞中的CTGF分泌。
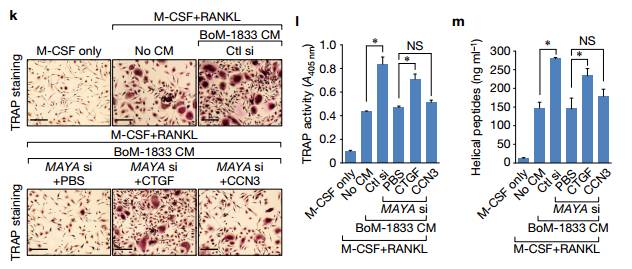
Kim 因此导致癌细胞诱导的破骨细胞分化和骨吸收受损,其可通过引入重组CTGF而部分挽救(图4k-m)。 Figure5 分析MAYA–LLGL2–NSUN6的联系
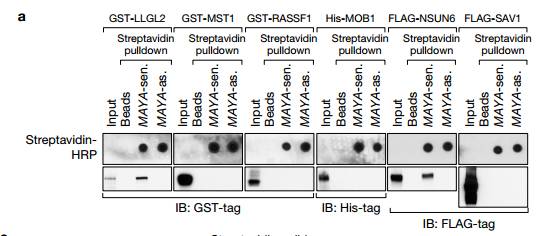
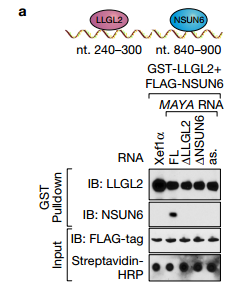
A将转录物与指定的重组蛋白一起温育用于体外链霉抗生物素蛋白RNA下拉测定,随后使用所示抗体进行IB检测,用细菌表达的重组蛋白进行体外RNA下拉揭示了只有LLGL2和NSUN6直接结合MAYA。
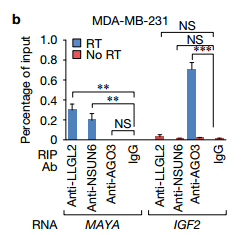
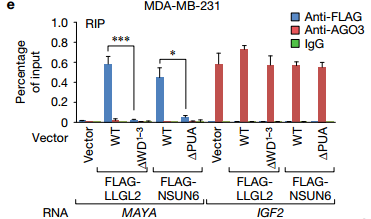
b在MDA-MB-231细胞中使用所示抗体进行RNA免疫沉淀(RIP)测定, RNA免疫沉淀(RIP)测定进一步证实了相互作用。 ab说明了细菌表达的重组蛋白进行体外RNA下拉揭示了只有LLGL2和NSUN6直接结合MAYA。
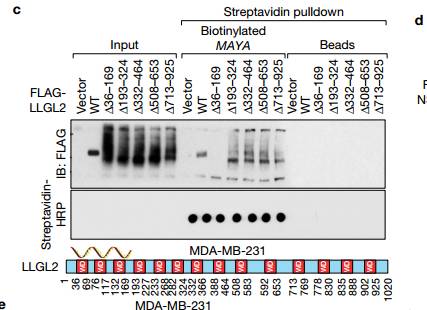
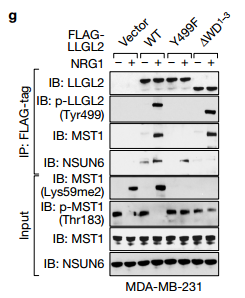
C LLGL2含有14个WD40重复序列,作为与RNA分子相互作用的支架,用于细胞功能。为了绘制LLGL2的RNA结合区域,作者在文中产生了一系列LLGL2缺失突变体,通过链霉素下拉实验发现LLGL2(136-169)的前三个WD40结构域(1WD1-3)的去除消除了MAYA-LLGL2相互作用。
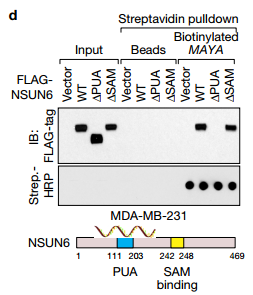
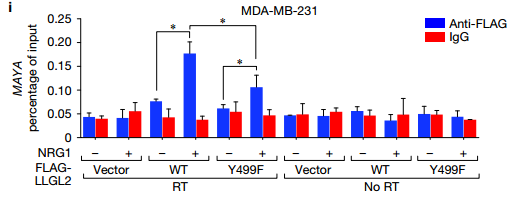
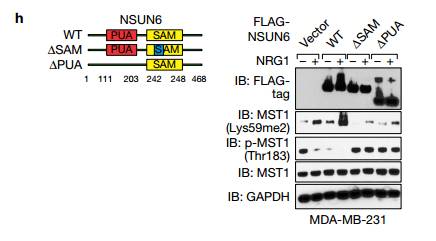
D 说明NSUN6(1111-203)的PUA结构域对于MAYA-NSUN6相互作用是必需的(图5d)。 LLGL2的WD40结构域1-3和NSUN6的PUA结构域对于MAYA结合的必要性通过RIP测定在体内证实 E 在用所示质粒转染的MDA-MB-231细胞中使用所示抗体的进行RIP分析。再一次验证了LLGL2的WD40结构域1-3和NSUN6的PUA结构域与MAYA相结合。
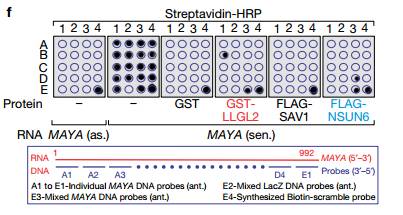
F 使用生物素化的MAYA进行体外RNA结合蛋白质免疫共沉淀,然后进行斑点印迹分析如所示的用重组蛋白的正义或反义转录物。 底部,针对MAYA的DNA探针的注释应用于印迹。说明MAYA的序列B1(核苷酸241-300)对于LLGL2结合是必需的,并且D3(核苷酸841-900)负责NSUN6结合。
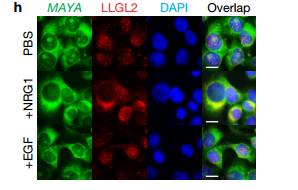
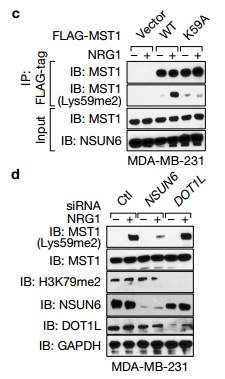
H RNA荧光原位杂交 用靶向MAYA的FISH探针在MDA-MB-231细胞测定靶向LLGL2的抗体。疫RNA FISH和RIP分析表明,MAYA与NRG1之后的LLGL2共定位刺激,其在LLGL2Y499F突变体存在下受损。 I 在NRG的刺激下对转染后的细胞进行RIP检测 Hi说明免疫RNA FISH和RIP分析表明MAYA与LLGL2共定位,NRG1刺激后,在LLGL2 Y499F突变体存在下受损 Figure6 LncRNA介导的,NSUN6依赖性甲基化抑制MST1的激酶活性
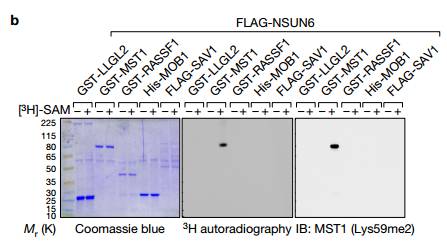
A 在FL MAYA而不是LLGL2或NSUN6缺失的存在下,细菌表达的LLGL2可以在体外下拉NSUN6,说明LLGL2-MAYA-NSUN6复合物可能负责Lys59上的MST1甲基化。
b使用重组FLAG-NSUN6和指示的具有或不具有[3H] -SAM的重组蛋白进行体外甲基化测定,然后用相应抗体进行IB检测,并观察到只有NSUN6能够在SAM(S-腺苷甲硫氨酸)存在下才能出现MST1甲基化。
Cd.作者发现MST1 Lys59突变成丙氨酸或NSUN6敲低,削弱了NRG1激活的MST1甲基化
Ef.敲除LLGL2或MAYA的沉默取消了MST1的甲基化,导致MST1在Thr183的过度磷酸化。
g作者为了进一步研究了LLGL2和NSUN6的调控作用在调节MST1甲基化。作者发现这两个LLGL2Y499F和1WD1-3缺失突变体取消配体诱导MST1甲基化,未磷酸化的LLGL2(Y499F)仍与NSUN6有关,但未能招募到MST1,1WD1-3 LLGL2突变体可招募MST1,但是未能与NSUN6相关联。
H 表达NSUN6 1SAM(1242-248)和1PUA(1111-203)突变体体内削弱MST1甲基化。
J NRG1诱导刺激下ROR1 KO,LLGL2 KO,NSUN6 KO和HER3 KO分别下调了37,40,29和21个基因。因此作者确定了确定了ROR1 / HER3-LLGL2-MAYA-NSUN6信号轴与Hippo通路之间的联系。 Figure7 ROR1/HER3–LLGL2/MAYA/NSUN6信号轴激活YAP
A 为了进一步证实机制性连锁,作者在ROR1 KO细胞中表达WT ROR1和K506A突变体进行拯救实验,发现野生型ROR1而不是K506A突变体的表达恢复了NRG1触发的表型。 B 我们使用HER3 Y1307E和LLGL2 Y499E磷酸化模拟突变体分别进行了拯救实验,HER3 Y1307E突变体介导了HER3-BCAR3相互作用和LLGL2向磷酸化HER3的募集。
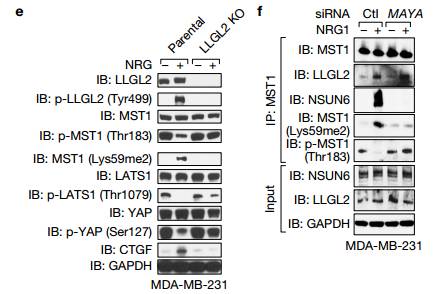
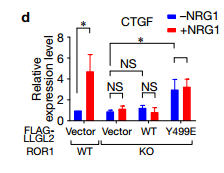
Cd 在ROR1KO细胞中表达LLGL2 Y499E突变体挽救了MST1甲基化和YAP1低磷酸化。
E 在乳腺癌中MAYA敲低显示对NRG1依赖性MST(Lys59)甲基化有显着影响,但LLGL2和NSUN6的突变体对MAYA敲低有拯救作用。但是对HER3(Tyr1307)和LLGL2(Tyr499)磷酸化的影响最小LLGL2和NSUN6的突变体拯救MAYA的表达。 Figure8 将MAYA作为一个对乳腺癌骨转移治疗有希望的靶点。
a MAYA敲低显示对NRG1依赖性的p-HER3(Tyr1307)和p-LLGL2(Tyr499)的影响最小,但对MST1(Lys59me2)和NRG1触发的MST1,LATS1,YAP1的低磷酸化和CTGF的表达有显着影响。 B 是FL MAYA的外源表达,而不是1LLGL2或1NSUN6在MAYA敲低的BoM-1833细胞中突变体挽救了这些表型。
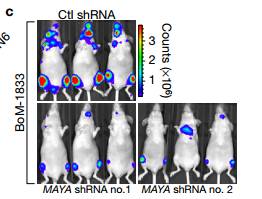
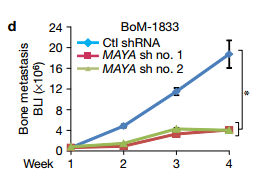
cd 然后我们研究了MAYA在乳腺癌骨转移中的作用,通过心内注射实验性转移鼠模型。与对照shRNA(Ctl)相比,诱导型MAYA敲低显著减少后肢肿瘤负担。
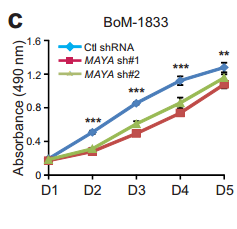
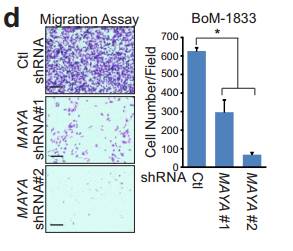
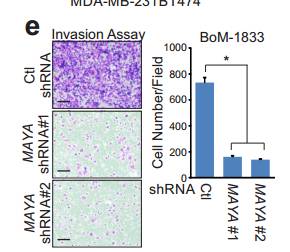
Cde MAYA敲低对乳腺癌231细胞增殖 迁移 侵袭的影响。
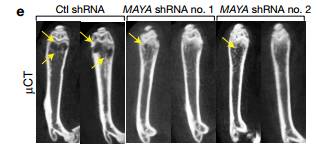
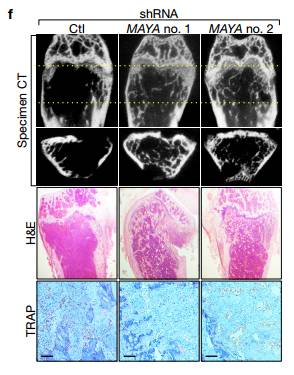
E Micro-CT成像显示用MAYA敲低细胞接种的小鼠表现出来胫骨骨损伤减少。
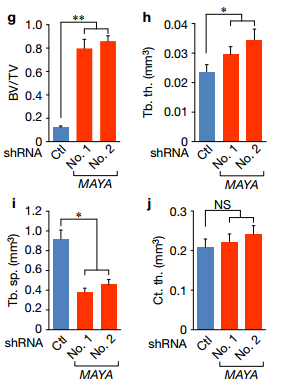
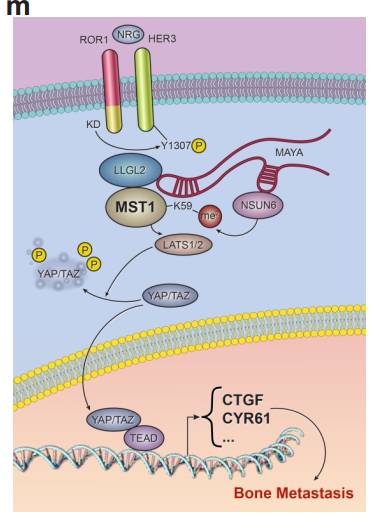
F MAYA KO增加了股骨中的小梁骨质量。 组织学HE和TRAP染色表明MAYA KO导致骨量破坏减少,破骨细胞相对也减少。 Ghij MICRO CT的量化分析证实了骨量,骨小梁厚度的增加和减小了骨小梁的间距,但MAYA KO时皮质骨厚度无明显差异。 总结: 作者在本文研究发现NRG1结合的ROR1/HER3异源二聚体lncRNA依赖的方式募集衔接子LLGL2和甲基转移酶NSUN6。LLGL2-MAYA-NSUN6模块在Lys59处甲基化MST1,其消除MST1的激酶活性,并因此导致LATS1和YAP的低磷酸化。 YAP被激活并积聚在细胞核中以刺激参与肿瘤细胞增殖和骨转移的靶基因表达。
对于TNBC和NSCLC患者,抗EGFR靶向治疗一直是主要的治疗方法之一。然而,关键的挑战在于如何克服对酪氨酸激酶抑制剂(TKI)的后天抵抗。已知的,EGFR突变与骨转移有关,骨转移细胞中高表达的ROR1表达和YAP途径激活表明ROR1和YAP通路联合靶向治疗骨转移的潜在治疗价值。事实上,ROR1与非小细胞肺癌患者的EGFR耐药有关。作者观察到,具有强p-HER3 Tyr1307染色的乳腺癌患者与低HER3染色的患者相比表现出不利存活的结果。表明p-HER3 Tyr1307和MAYA可以用作预测骨转移的预测性生物标志物并其开始发现具有针对性的抗-EGFR疗法。 参考文献(对话框内回复“JC68”下载文献原文): 1 Li C, Wang S, Xing Z et al. A ROR1-HER3-lncRNA signalling axis modulates the Hippo-YAP pathway to regulate bone metastasis. Nat Cell Biol 2017; 19:106-119.返回搜狐,查看更多 各位读者: |
【本文地址】