双管齐下战“狼疮”!首个双靶点生物制剂即将在国内获批 |
您所在的位置:网站首页 › EI001单抗靶点 › 双管齐下战“狼疮”!首个双靶点生物制剂即将在国内获批 |
双管齐下战“狼疮”!首个双靶点生物制剂即将在国内获批
|
SLE的诊疗还有很多问题要解决 (图片来源: Trends in Molecular Medicine )
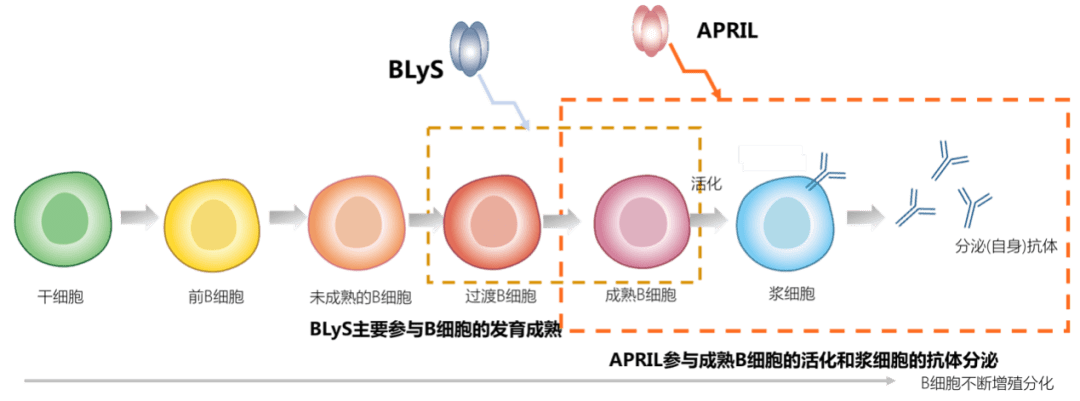
双管齐下, 全方位抑制异常B细胞的“一生” 众所周知,SLE的发病主要与患者体内的B细胞出现异常,产生大量致病性自身抗体有关,但导致B细胞异常的机制也很复杂,各种亚群的T细胞、巨噬细胞以及其他内外因素都参与其中,因此,目前SLE的发病机制仍未完全阐明。 虽说矛盾多多,但还是得先抓主次。归根结底,SLE发病最主要的原因就是B细胞异常,而目前“收拾”这些异常B细胞的思路有两种,一种是靶向特定位点对其进行直接攻击,比如靶向CD20的利妥昔单抗。 另一种思路则是抑制多种在异常B细胞成熟和增殖过程中起到关键作用的细胞因子,从而减少异常B细胞产生致病性自身抗体。 研究发现,与SLE有关的重要细胞因子包括B淋巴细胞刺激因子(BLyS,又名B细胞活化因子/BAFF)、增殖诱导配体(APRIL)等。 BLyS和APRIL会与体内异常的B细胞结合,导致原本应该被清除的异常B细胞得以存活。两种细胞因子在SLE发病机制中的功能也不尽相同,BLyS主要参与B细胞的发育成熟,而APRIL与B细胞活化和分泌抗体有关。因此抑制BLyS或APRIL,在理论上可以减少异常B细胞,降低患者的疾病活动度。
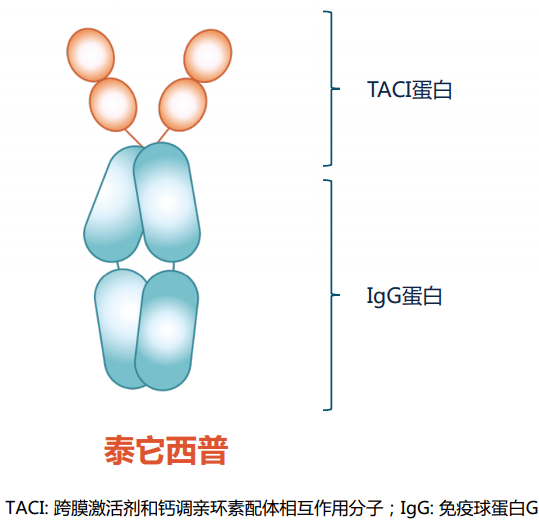
这张图信息量更大更详尽 在靶向这两个位点的药物设计上,研究者也采用了两种并行的思路。 一种是单独靶向BLyS,例如已经获批用于治疗SLE的贝利尤单抗以及折戟临床III期研究的Tabalumab [6]。 另一种就是“双靶点生物制剂”, 能同时靶向BLyS和APRIL,因为二者存在TACI、BCMA等三种共用受体,在理论上能被一种药物共同抑制。 首个靶向BLyS/APRIL双靶点的生物制剂是Atacicept,它与贝利尤单抗几乎同步进入临床研究,但在一项预防中重度SLE患者狼疮再发的临床III期试验中,75 mg Atacicept组未体现明显疗效优势,而150 mg组则因两例患者的安全问题提前终止 [7]。 虽然Atacicept在临床试验中遗憾失利,但同时靶向BLyS/APRIL的治疗价值仍值得继续探索,改进药物的安全性、优选更需要、更适合双靶向生物制剂的患者,就能沿着这条路继续走下去。 疗效安全性双优, 有望改写中国SLE患者治疗历史 由我国自主研发的生物制剂新锐泰它西普(Telitacicept),在“前浪”的基础上更进一步:它的临床II期试验结果于2019年底的美国风湿病学会(ACR)年会被口头报告,并被列为“压轴级别”的延迟公布摘要(Late-Breaking Abstract,LBA)之一。 能成为国际级学术会议的LBA级研究之一,泰它西普靠的是试验中体现出的显著疗效和安全性,它的成功源自药物设计上的进步,也标志着“中国智造”的力量。 泰它西普并不是单抗类药物,而是TACI-Fc融合蛋白型生物制剂,通过重组DNA技术将能够抑制BLyS/APRIL双靶点的TACI蛋白基因片段和人体IgG蛋白的Fc基因片段融合在一起,表达出来的蛋白就能同时具备两种蛋白的特点。
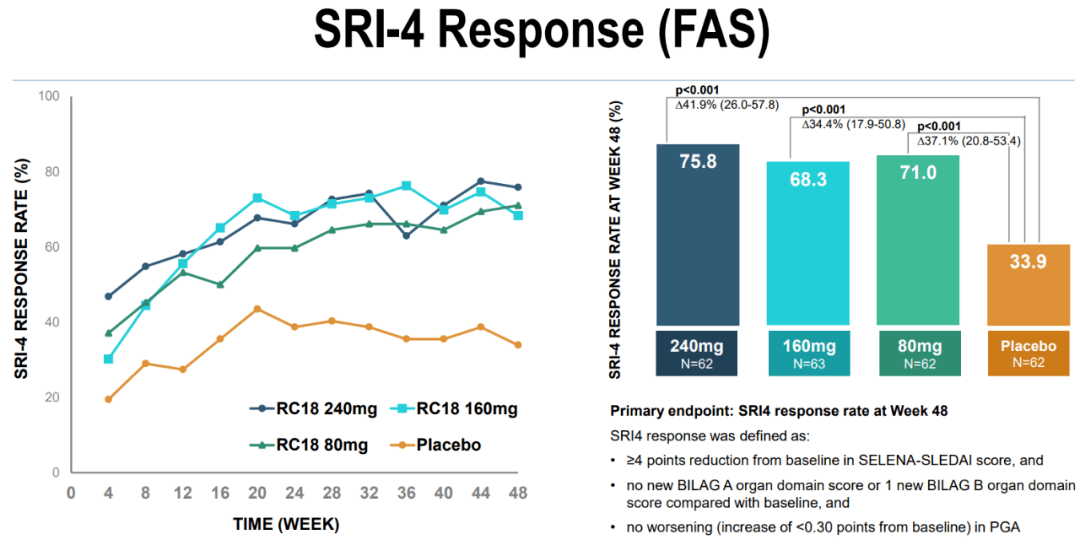
“融合蛋白型”生物制剂长这样 虽然思路相似,但泰它西普在设计上较Atacicept更优化,临床前研究数据显示, 与Atacicept相比,泰它西普结合并抑制BLyS/APRIL的能力提升了一倍[8]。药理学特性的提升也为泰它西普临床试验的成功奠定了基础。 在2019ACR年会上公布的一项多中心、随机、双盲、安慰剂对照的临床II期试验,共纳入249例SLE患者,患者被分为四组,每周分别接受一次80 mg、160 mg、240 mg泰它西普治疗或使用安慰剂。 试验结果显示,160/240 mg泰它西普组的SRI4应答率分别为68.3%和75.8%,都显著优于安慰剂组的33.9%,而且泰它西普起效迅速,治疗4周时应答率明显高于安慰剂组,患者异常IgG、IgM和IgA抗体的水平也相对更低 [9]。
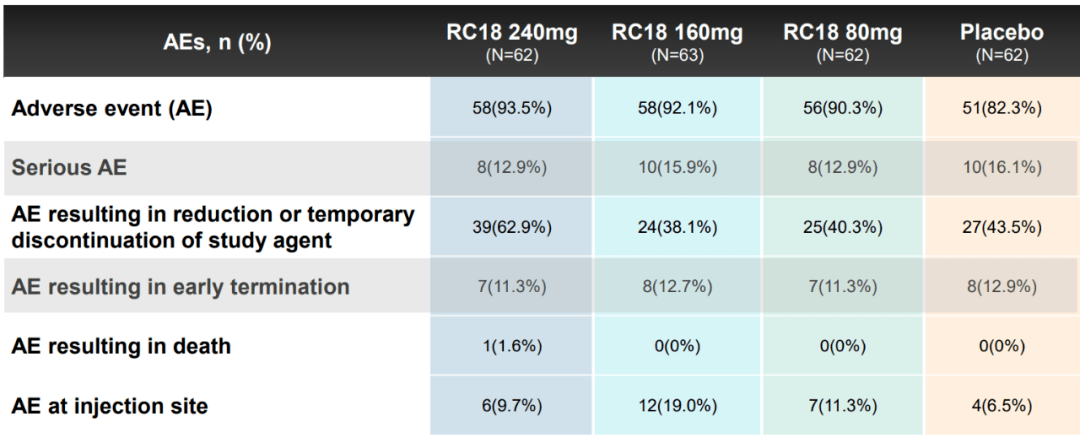
不同剂量泰它西普与安慰剂的疗效对比,都达到了显著性差异 在疗效上,泰它西普不仅表现出应答率高、迅速起效的特点,在安全性方面的表现也同样出色: 治疗组呼吸道感染、注射部位反应等不良事件的发生率和严重程度,以及不良事件导致的剂量调整或停药发生率基本与安慰剂组相当,患者的耐受性较好。
评价生物制剂治疗,安全性很关键 正是基于出色的疗效和安全性, 泰它西普已向国家药品监督管理局(NMPA)提交上市申请,并获优先审评。泰它西普为中国SLE患者提供新的治疗选择,也将带动国内诊疗指南和临床实践的变革。 为进一步验证临床II期试验的结果,美国FDA也授予泰它西普快速审批通道(Fast Track)的资格,泰它西普治疗SLE的临床III期试验已在国内启动,并将在美国同步启动类似试验,争取尽快走上国际舞台。 即使进入生物制剂时代,战胜SLE这只“狼”仍然不易,但小编一直相信,随着创新药物源源不断地涌现,再强的“狼”也会被打垮。如果引领“战狼”的是国产创新药物,那将会是历史性的一刻。 参考资料: 2.Wang Z, Wang Y, Zhu R, et al. Long-term survival and death causes of systemic lupus erythematosus in China: a systemic review of observational studies[J]. Medicine, 2015, 94(17). 3.中华医学会风湿病学分会. 2020中国系统性红斑狼疮诊疗指南[J].中华内科杂志, 2020, 59(3): 172-185. 4.Dooley M A, Houssiau F, Aranow C, et al. Effect of belimumab treatment on renal outcomes: results from the phase 3 belimumab clinical trials in patients with SLE[J]. Lupus, 2013, 22(1): 63-72. 5.Wallace D J, Navarra S, Petri M A, et al. Safety profile of belimumab: pooled data from placebo-controlled phase 2 and 3 studies in patients with systemic lupus erythematosus[J]. Lupus, 2013, 22(2): 144-154. 6.Isenberg D A, Petri M, Kalunian K, et al. Efficacy and safety of subcutaneous tabalumab in patients with systemic lupus erythematosus: results from ILLUMINATE-1, a 52-week, phase III, multicentre, randomised, double-blind, placebo-controlled study[J]. Annals of The Rheumatic Diseases, 2016, 75(2): 323-331. 7.Isenberg D, Gordon C, Licu D, et al. Efficacy and safety of atacicept for prevention of flares in patients with moderate-to-severe systemic lupus erythematosus (SLE): 52-week data (APRIL-SLE randomised trial)[J]. Annals of The Rheumatic Diseases, 2015, 74(11): 2006-2015. 8.Chen X, Hou Y, Jiang J, et al. Pharmacokinetics, pharmacodynamics, and tolerability of single ascending doses of RCT-18 in Chinese patients with rheumatoid arthritis[J]. Clinical Pharmacokinetics, 2014, 53(11): 1033-1044. 图片来源:Pixabay 作者:奇点糕 来源:奇点网返回搜狐,查看更多 |
【本文地址】
今日新闻 |
推荐新闻 |