免疫系统:“吃还是不吃癌细胞,这是一个问题 ” |
您所在的位置:网站首页 › 90后博士高敏对癌细胞怎么治平时吃什么饭 › 免疫系统:“吃还是不吃癌细胞,这是一个问题 ” |
免疫系统:“吃还是不吃癌细胞,这是一个问题 ”
|
原创 Cell Press CellPress细胞科学  交叉学科 Interdisciplinary “吃我”信号和“别吃我”信号是两类特定的关键信号,他们可以通过调节吞噬过程的复杂性,确定哪些细胞适合被吞噬。这些信号可以直接或间接地改变巨噬细胞行为。肿瘤细胞通常会上调“别吃我”信号,逃避被巨噬细胞吃掉的命运,让自己能不受控制的增殖。相反,凋亡细胞会表现出“吃我”信号,让巨噬细胞精准定位,防止它“误食”附近的正常细胞。基于“吃我”/ “别吃我” 信号的治疗方法会改变巨噬细胞表型和行为,如果将其应用于癌症免疫治疗中,可能会为癌症的治疗开辟新途径。 本篇综述文章对相关信号通路和免疫细胞进行了梳理,相关结果或可指导未来癌症新疗法的发展。2023年10月,这项文章以“Don't eat me/eat me signals as a novel strategy in cancer immunotherapy”为题,发表在Cell Press细胞出版社期刊Heliyon上。 【论文摘要】 癌症是全球最主要的死亡原因之一,其发病负担不断增加,导致死亡率显著上升。癌症治疗已经发展出多种策略,但每种都有其缺点,可能对患者生活质量产生负面影响。目前癌症治疗仍然是一个重大挑战。基于免疫学的策略为对抗癌症和免疫相关疾病提供了新方法。该方法的一个特定子集识别了癌细胞中的“吃我”和“别吃我”信号,有可能标志着在治疗各种癌症方面取得重大突破。 巨噬细胞作为免疫系统的重要组成部分,调节代谢平衡,控制炎症性疾病,监督纤维化,并在损伤修复中发挥作用。然而,在肿瘤细胞环境下,CD47、PD-L1和beta-2微球蛋白(B2M)等“别吃我”信号的过度表达,使得肿瘤细胞能够逃脱巨噬细胞并不受控制地增殖。相反磷脂酰丝氨酸(PS)、细胞表面电荷和糖基化模式的改变、细胞粘附分子-1(ICAM-1)表位的修饰、以及钙网蛋白和PS在细胞膜外层的暴露等“吃我”信号的表达,代表了几乎所有凋亡细胞表面普遍观察到的变化,防止吞噬作用对邻近的非肿瘤细胞造成伤害。 这篇综述提供了有关信号通路和免疫细胞如何刺激或阻碍这些信号的见解,旨在解决未来免疫疗法研究可能出现的难题。 【简介】 癌症是全球最主要的死亡原因之一,其发病负担不断增加,导致死亡率显著上升。传统的癌症治疗主要依赖于:手术、放疗和化疗。然而,每种方法都存在固有的问题和缺陷,可能对癌症患者的生活质量产生不利影响。因此,在医学领域,实现一种最大程度减少并发症和限制的明确癌症治疗方法仍是一个重大挑战。 过去十年中涌现了许多创新技术,通过利用人体内天然细胞的固有能力,提供了癌症治疗的潜在解决方案。新的治疗途径包括免疫疗法、细胞疗法、基因疗法和激素疗法,已被作为克服这些局限性的策略。基于免疫学治疗的领域正在迅速扩展,其中一个子集专注于识别癌细胞表面的“吃我”和“别吃我”信号。该方法涉及将这些信号在癌细胞和非癌细胞上的呈现进行比较。 巨噬细胞是免疫系统的关键组成部分之一,具有显著的结构多样性,并在代谢稳态、炎症管理、纤维化过程和伤口愈合等方面发挥多样化的作用。巨噬细胞在细胞免疫中起着将抗原呈递给T细胞的基本作用,将其称为“抗原呈递细胞(APCs)”。最近的研究已经确立了抑制性和刺激性信号对调控恶性细胞的天然免疫系统吞噬作用的重要性。对致病、垂死或失活细胞的充分清除依赖于宿主细胞表面显示的“吃我”和“别吃我”信号所引发的吞噬反应。 肿瘤细胞通常会上调“别吃我”信号,如CD47、程序性细胞死亡配体1(PD-L1)和B2M。这些信号使癌细胞能够逃避巨噬细胞清除,导致不受控制的增殖。相反,凋亡细胞中普遍表现出“吃我”信号,如PS、表面电荷和糖基化模式的改变、ICAM-1表位的变化,以及钙网蛋白和PS在外部细胞膜上的暴露。这些变化防止附近的非肿瘤细胞受到吞噬作用的伤害。 通过定向巨噬细胞转录机制和转录后调控,这些信号可以直接和间接地改变巨噬细胞行为。这些过程影响基因的表达和细胞因子的产生,导致巨噬细胞表型的改变。例如,将“别吃我”信号与巨噬细胞结合可以增加吞噬作用,减少促炎细胞因子的产生,并增加抗炎细胞因子的产生。这些方法通过修饰细胞表面分子和受体来重塑巨噬细胞的表型,使巨噬细胞能够作为针对感染的主要防御者,潜在地增强了医疗治疗的效力。此外,这一策略已有效减少了由病原体引起的炎症和组织损伤、增强了巨噬细胞识别和对抗病原体的能力可以加速免疫反应,帮助机体对抗感染、还限制了感染在全身的传播,减轻了与感染相关的炎症和组织损伤。“吃我”和“别吃我”信号在癌症发病机制中具有重要意义,探索与这些信号相关的机制和分子可以为改进癌症治疗铺平道路,重点关注创新的免疫治疗方法。本综述探讨了参与调节这些信号的通路和免疫细胞,旨在寻求解决未来在深入研究癌症免疫疗法时可能遇到的挑战。 【“吃我”和“别吃我”信号:是什么?有什么用?】 在多细胞生物领域,细胞凋亡或程序性细胞死亡在各种基本过程的发挥着关键作用,包括形态发生、细胞稳态、损伤修复、免疫耐受和炎症减轻。例如,在神经发生和视网膜发生过程中,组织重塑至关重要,需要通过凋亡来消除高达50%的多余神经元。肝脏中的库普弗细胞,即肝脏中的驻留巨噬细胞,每秒估计吞噬超过2.4×106个红细胞。此外,每天约有1×1011个循环中性粒细胞在不断更新。在中枢免疫耐受中,约有95%的成熟T细胞通过负选择在胸腺内被消除。虽然自体凋亡细胞和外来感染可以通过吞噬来清除,但所产生的免疫效果存在显著差异。经过补体和Fc受体介导的调理病原体吞噬会引发促炎反应。相反,吞噬凋亡细胞会触发抗炎反应。这一特定过程被称为胞葬作用(efferocytosis),这个术语源自希腊语单词“Affero”,意味着运送到坟墓或埋葬。 特定的关键信号用于调节吞噬过程的复杂性,并确定哪些细胞适合被吞噬。这些信号分为两个不同的类别,即“吃我”信号和“别吃我”信号,对于是否将细胞识别为吞噬目标或免除此命运至关重要。 1.“吃我”信号 最近的研究揭示了凋亡细胞发出的四种“找到我”信号。这些信号包括脂质溶解磷脂酰胆碱、鞘氨醇1-磷酸、趋化因子CX3CL1、核苷酸ATP和UTP。尽管样式很多,但所有这些分子都与引导巨噬细胞或单核细胞靠近凋亡细胞相关。尽管这些“找到我”信号在引导吞噬细胞接近垂死细胞方面提供帮助,如何让吞噬细胞准确识别垂死细胞,而不是众多的活细胞,仍然是一个大难题。为了实现这一点,必须在凋亡细胞的表面呈现特定的标记,这些标记被称为“吃我”信号。这个识别过程类似于在一排住宅中识别特定的房屋,就像在复杂情景中发现火源一样。“找我”信号类似于火警报警器,将消防救援队引导到起火房屋的确切位置(在这种情况下是“吃我”信号)。值得注意的是,许多“吃我”信号明显显示在凋亡细胞的表面上。这些信号包括PS的外露、细胞表面电荷和糖基化模式的改变、ICAM-1的表位变化以及内质网中钙网蛋白的存在。其中,PS的外露主要是“吃我”信号的关键触发器。 2.“别吃我”信号 尽管大多数活细胞不显示“吃我”信号,但某些生理情况,如淋巴细胞激活、骨骼肌发育和精子—卵子融合,会促使一些活细胞暂时呈现类似垂死细胞的标记。这些“别吃我”信号因此表达为一种额外的调节机制,以防止活细胞被不当去除。大多数明确定义的抗吞噬受体是属于免疫球蛋白超家族的单传透I型跨膜蛋白,其胞质尾部具有一个或多个免疫受体酪氨酸激酶抑制性基序(ITIM)。传统的ITIM共识序列是(I/V/L)xYxx(L/V),其中x代表任意氨基酸。许多抗吞噬受体还包括免疫受体酪氨酸基交换基序(ITSM)、补充蛋白质结合结构域和非经典的“类ITIM”基序,其序列更为多样(I/V/L/SxYxxL/V/I)。抗吞噬受体的激活会触发细胞质ITIM的酪氨酸磷酸化,从而激活含有SH2结构域的胞质磷酸酶,包括SHP酪氨酸磷酸酶和SHIP1/2肌醇磷酸酶。尽管识别它们的下游底物一直存在挑战,但这些磷酸酯酶作为抗吞噬受体的下游效应器发挥作用,促进了抗吞噬受体的抑制作用。 【吞噬作为癌症免疫治疗的潜在途径】 1.在癌症免疫治疗中利用“吃我”信号 在癌症免疫治疗中利用“吃我”信号已成为研究人员关注的热门课题,因其潜力巨大且具有广泛的影响。人们正在研究各种策略,将“吃我”信号整合到免疫治疗中,以提高治疗剂在患者体内的有效性和效率。不管大小和形状如何,多达99%的纳米颗粒都会在肝脏中被消除,这是癌症治疗中的一个大难题。这可以归因于组织驻留的巨噬细胞识别、攻击、捕获和清除外来实体的现象。利用“吃我”信号的一个可行途径是利用胞外囊泡作为这一信号的载体。另一种策略涉及通过使靶细胞更易被巨噬细胞和其他免疫系统组分察觉来增强吞噬。癌细胞通常利用“吃我”和“别吃我”信号来规避吞噬细胞的破坏。越来越多的证据表明,突出抗原呈现,并利用巨噬细胞和树突状细胞对肿瘤的影响,可以大大对化疗和放疗等传统治疗方法进行补充。在肿瘤免疫原性细胞死亡(ICD)领域,其构成一种凋亡形式,钙网蛋白转运到细胞表面起到了关键的作用,充当“吃我”信号。在ICD期间,钙网蛋白与吞噬细胞中的低密度脂蛋白受体相关蛋白1(CD91)相互作用。虽然药物可以提高表面钙网蛋白水平以促进ICD,但CD47表达会平衡和减轻钙网蛋白的作用。 除了治疗干预之外,氧化铁等纳米材料也具有在医学成像中的潜力,包括MRI和正电子发射断层扫描等技术。在免疫疗法中利用“吃我”信号的再一个途径在于分析治疗过程和表现出药物活性和功能的成像部位。PS作为细胞膜的一部分,在细胞凋亡阶段起到“吃我”信号的作用,如下图。 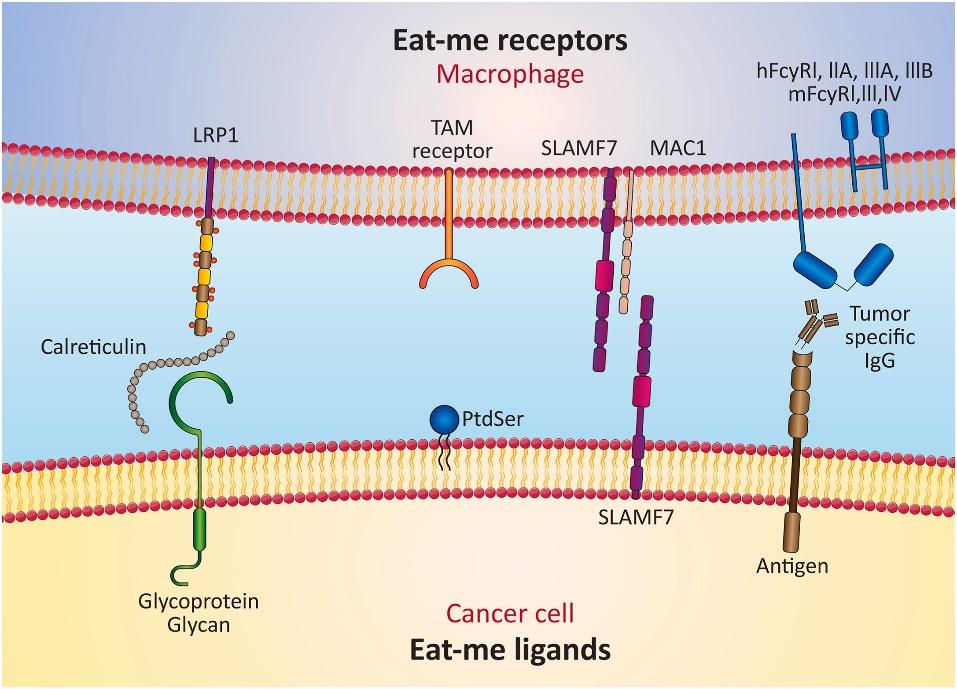 2.揭示癌症免疫治疗中的“别吃我”信号 肝脏具有最大浓度的组织驻留巨噬细胞。这些巨噬细胞负责捕获和清除外来物质。细胞凋亡是一种程序性的细胞死亡机制。吞噬细胞在释放细胞内成分之前检测和吞噬垂死细胞,从而防止免疫原材料的暴露和随后的炎症反应。这一过程本质上是生理性的,其中它的破坏或调节可能与病理性状况相关,可能会催化某些疾病。清除异常或患病细胞对于适当的发育、组织完整性以及对防御致病性和免疫原性伤害至关重要。专业和非专业吞噬细胞都参与了细胞凋亡。专业吞噬细胞包括巨噬细胞和不成熟的树突细胞,以其相对快速的反应而闻名。相比之下,非专业吞噬细胞由位于垂死细胞附近的组织驻留细胞组成,展示出较慢的摄入细胞能力。此外,天生免疫细胞被视也为专业吞噬细胞,因具有识别和迁移向靶向目标细胞、并吞噬多个目标的能力。 为了保护健康细胞,控制的吞噬过程是必不可少的。这一过程分为四个阶段:“嗅觉”“品味”“摄入”和“消化/反应”。在“品味”阶段,对目标细胞上的“吃我”和“别吃我”信号的“综合”识别是必要的,两者都表达在目标细胞上。“吃我”信号包括抗体、补充调理素、钙网蛋白、氧化低密度脂蛋白、细胞结合血小板反应蛋白以及其他表面蛋白修饰。通常情况下,正常活细胞不表达“吃我”信号。在生理环境中存在例外情况,例如在淋巴细胞激活、骨骼肌形成和精子—卵子融合期间可以短暂地看到这一信号的表达。因此,健康细胞表面存在“别吃我”信号可以免受不合理的清除。在癌细胞领域,“别吃我”信号被利用来逃避天生免疫系统的检测,从而有效地避免巨噬细胞等初始反应细胞的消除。 CD47作为一种糖蛋白,其相互作用伙伴是信号调节蛋白α(SIRPα)。通过其信号传导,CD47/SIRPα轴有助于几个生理恒态过程。正常组织表现出适度的CD47表达,而肿瘤通常表现出过度表达。癌细胞通过提高CD47蛋白表达作为一种机制来规避免疫驱动的清除。值得注意的是,它是一个强大的“别吃我”信号,其过度存在表征实体和血液性肿瘤,包括急性白血病、非霍奇金淋巴瘤、结肠直肠癌和卵巢癌。在许多恶性肿瘤中,这种上调与总体不利的预后相一致。抑制CD47信号可以激发巨噬细胞吞噬活性,导致肿瘤生长受损,抑制转移性扩散,甚至肿瘤退缩。 另一个值得注意的“别吃我”信号也会来自CD24,它与肿瘤相关巨噬细胞上的抑制性受体液酸结合免疫球蛋白样凝集素-10相互作用。许多肿瘤表现出CD24过表达,尤其是卵巢和乳腺癌。施用抗-CD24抗体明显减少了小鼠模型中的肿瘤生长。因此,引起对“别吃我”信号的关注成为癌症免疫疗法领域的一条新途径,如下图。“别吃我”信号可以通过单克隆抗体、小分子和肽促进巨噬细胞吞噬。针对癌症疗法中的“别吃我”和“吃我”信号的有针对性疗法正在开发,强调了它们在癌症疗法临床试验中的重要作用。 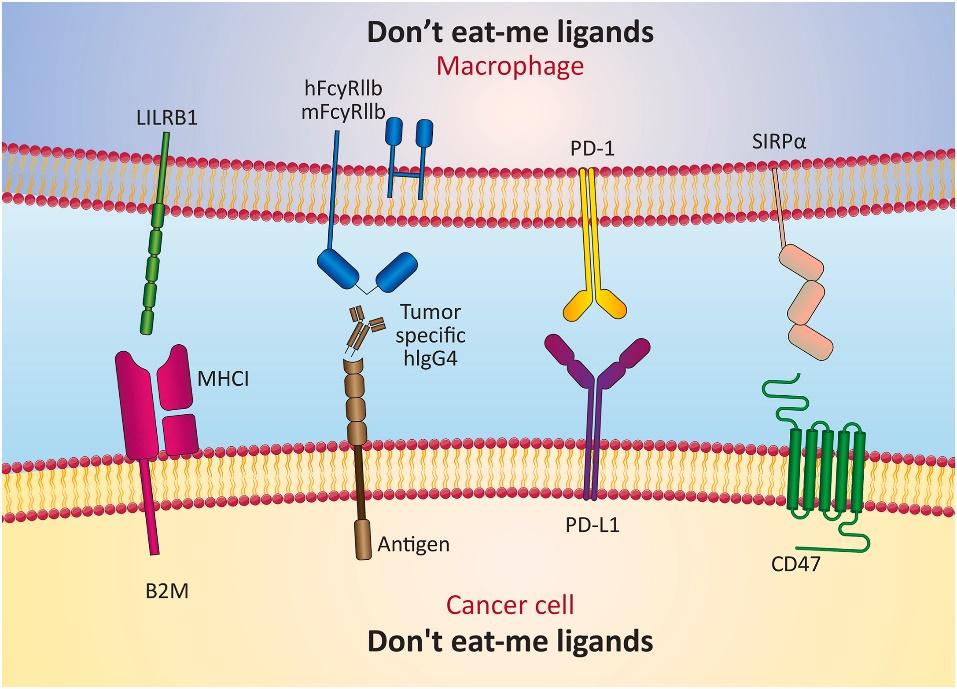 【巨噬细胞中吞噬信号通路的调节】 在对抗癌细胞时,天然免疫系统是一个关键角色,巨噬细胞在这个复杂过程中占据中心位置。巨噬细胞与天然免疫系统的其他成分合作,以识别感染或恶性细胞展示的受体和表面分子,随后启动吞噬作用。这些事件是由多种信号协调完成的,可分类为不同的组。首要分类是“找到我”信号,包括促进巨噬细胞朝着癌细胞招募的吸引信号。当巨噬细胞到达癌细胞附近时,这些细胞发出信号来引导吞噬,被称为“吃我”信号。相反,特定细胞通过表达“别吃我”信号来阻止吞噬。癌细胞的一个显著特点在于它们倾向于在信号互动中增加“吃我”和“别吃我”信号的表达。随后的相互作用可以概括如下图。 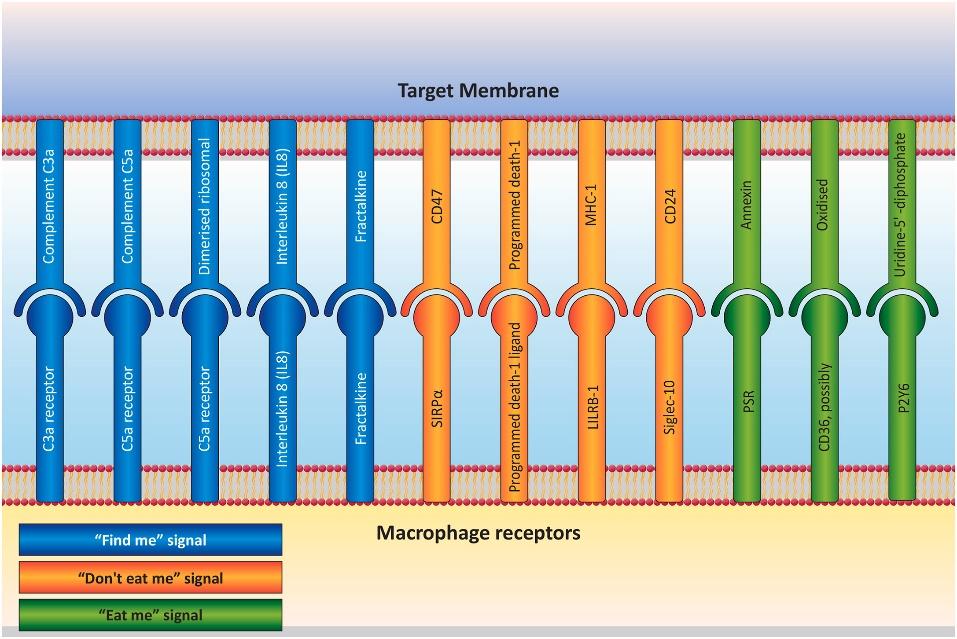 1.CD47-信号调控蛋白α SIRPα家族包括三个成员:α、β和γ。在这些亚型中,α型与CD之间的相互作用抑制了巨噬细胞对癌细胞的吞噬,使它们能够逃避这一过程。这种相互作用充当“别吃我”的信号,并阻碍了吞噬过程。癌细胞在其表面显示出比非恶性细胞更高的CD47水平。许多研究已经证明了CD47在各种肿瘤类型中的过度表达,包括骨髓瘤、平滑肌肉瘤、急性淋巴细胞白血病、非淋巴瘤、霍奇金淋巴瘤、骨肉瘤和头颈部鳞状细胞癌。通过利用“别吃我”的信号,癌细胞利用CD47的过度表达来逃避免疫细胞的监测和清除,使CD47成为新型抗肿瘤疗法的潜在靶点。 抗CD47药物通过不同的途径发挥其抗肿瘤作用。例如它们破坏CD47-SIRP抑制性信号,增强了巨噬细胞介导的肿瘤细胞吞噬。在目标细胞清除增加而避免清除重要细胞类型的情况下,抑制CD47-SIRP轴成为一种有吸引力的治疗选择。目前,对CD47-SIRP信号通路的抑制剂分为三类,处于不同的开发阶段:通过靶向靶细胞上的CD47分子来阻止通路活动的分子,通过靶向免疫效应细胞上的SIRP分子来阻止通路活动的分子,以及抑制CD47成熟所必需的QPCTL酶。 CD47具有扩展的N-末端细胞外结构域和5个跨膜螺旋,与SIRPα相互作用,对巨噬细胞发出“别吃我”的信号,干扰这种相互作用允许吞噬活癌细胞。采用多种策略来实现这一目标,包括靶向CD47或SIRPα结合位点的抗体、与内源蛋白竞争CD47或SIRPα结合的重组蛋白、以及靶向调控CD47转录的通路,抑制其在癌细胞表面的表达。CD47是主要的“别吃我”配体,而其巨噬细胞上的受体 SIRPα 会抑制肌球蛋白 II 聚合,这是启动细胞吞噬的关键步骤。 2.PD-1/PD-L1 肿瘤细胞中存在另一个“别吃我”信号,以防止其被巨噬细胞,特别是肿瘤相关巨噬细胞(TAM)吞噬。除了巨噬细胞外,PD-L1的表达也在其他各种细胞类型中观察到。许多研究已广泛调查了巨噬细胞中PD-L1的表达与癌症患者预后之间的相关性。考虑到通用的配体—受体相互作用,人们可能会认为PD-L1/PD-1结合在巨噬细胞和T细胞中的作用保持一致。然而,Singhal等人通过证明,在巨噬细胞上表达的PD-L1并没有抑制T细胞的反应;相反,它保护了巨噬细胞免受T细胞介导的破坏。这一发现与肿瘤细胞中PD-L1的效应相矛盾。 鉴于PD-L1和PD-1形成一对配体受体,PD-L1作为与其配体PD-1相互作用时对宿主巨噬细胞的影响可能被忽视了。这种现象是由于人们传统上将PD-1视为主要受体。一项研究表明,在用PD-L1抗体治疗后,表达PD-L1的巨噬细胞体积增大、活性增加。此外,它们的增殖和存活能力也得到了改善。类似地,用可溶性CD80和可溶性PD-1治疗导致了巨噬细胞尺寸增大、形态改变,并且CD86、主要组织相容性复合物II和TNF-α的产量增加。sCD80的治疗效果超过了sPD-1的治疗效果。 此外,PD-L1信号抑制了巨噬细胞中的mTOR通路,引发了其转录组的变化。根据这些观察,PD-L1似乎在巨噬细胞的增殖和活化中发挥了调控作用。另一项研究表明,抑制巨噬细胞中的PD-L1产生减少了M2标志物IL-10和精氨酸酶-1的表达,同时增加了M1标志物IL-12和TNF-α的表达。 3.MHC I-LILRB1 MHC I(主要组织相容性复合物I)是许多体细胞中的分子,肿瘤细胞也显示这种分子,以逃避吞噬过程。巨噬细胞表面上对这种分子的受体是LILRB1。位于19q13.42染色体上的一段基因负责编码属于白细胞免疫球蛋白样受体(LILR)家族的蛋白质。LILR家族成员具有胞外免疫球蛋白样结构域。在LILR家族中,激活受体属于LILRA亚家族,称为LILRA1-5,因其包括免疫受体酪氨酸激活基序(ITAMs)而闻名。 相反,B亚家族LIR受体,称为LILRB1-7,包含多个细胞质ITIMs。LILRB亚家族在骨髓源细胞、树突状细胞、B细胞、自然杀伤细胞的亚群和T细胞中表达,比其他LILR家族成员具有更广泛的分布。LILRB受体由三个部分组成:一个胞外Ig样结构域、一个跨膜结构域和一个包含ITIM序列的细胞质结构域。与LILRB1的结合需要α3结构域和β2m亚单位的MHC I分子。通过用I型干扰素处理,可以增强LILRB1蛋白对HLA-I二聚体的亲和力。LILRB1表现出较强的结合倾向于HLA-I二聚体。HLA-I表达的程度与结合水平不相关。在T细胞上,LILRB1的表达可以与CD8竞争结合MHC I分子,需要β2m存在才能将HLA与LILRB1受体结合。与MHC I和CD8的组合不同,MHC I和LILRB1的组合由于LILRB1对MHC I的较高亲和力和较慢的离解速率,能够向T细胞传递抑制信号。LILRB1细胞质尾部中的ITIMs的存在与这些发现一致,表明MHC I和LILRB1之间的相互作用是抑制免疫反应的免疫通路的一部分。 4.CD24-Siglec-10 另一个值得注意的“别吃我”的信号成分是CD24分子,其在卵巢和乳腺等器官的肿瘤细胞中表达升高,促使肿瘤相关巨噬细胞表达其相应的配体Siglec-10。通过利用针对CD24和Siglec-10的基因敲除技术,以及设计用于阻断这些分子的单克隆抗体,研究人员观察到巨噬细胞吞噬肿瘤的能力显著增强。因此,已经在体内观察到了依赖于巨噬细胞的肿瘤生长减缓的结果。这一重大发现源于采用基因敲除方法来中和 CD24 和 Siglec-10 以及针对这些分子的单克隆抗体干预的实验结果。 此外,抑制CD24引发了所有表达Siglec-10的巨噬细胞的反应,这些反应的强度与Siglec-10的存在相关。CD24抑制作用的下降显示出源于Siglec-10的缺失。这些发现表明,涉及CD24和Siglec-10的一系列相关事件最终导致了CD24的特异性阻断。与Siglec-3和Siglec-5不同,CD24已被证明对Siglec-10表现出独特的结合亲和力。抑制信号级联的启动是由 CD24 和 Siglec-10 之间的相互作用引起的。结合后,一旦 SRC 家族酪氨酸激酶磷酸化细胞内基于酪氨酸的信号转导簇,Siglec-10 就会激活含有 SH2 结构域的蛋白质,尤其是 SHP-1、SHP-2 或细胞因子信号传导抑制剂 3。作为酪氨酸磷酸酶家族的重要成员,SHP-1选择性地附着在细胞内ITIM结构域中磷酸化的酪氨酸残基上,催化它们的去磷酸化。SHP-1调节了细胞内信号转导,包括生长因子、细胞因子、激素、细胞外基质和细胞粘附分子。因此,CD24和Siglec-10之间的相关性阻碍了巨噬细胞吞噬,从而防止通过吞噬来清除肿瘤。这种现象有助于提高恶性肿瘤的免疫逃逸能力。 5.钙网蛋白 钙网蛋白(CRT)充当“吃我”信号,属于内质网凝集素伴侣家族成员。它在触发吞噬和随后的免疫反应中至关重要。CRT向细胞表面的转位是由细胞压力和DNA损伤引起的。当被糖蛋白和糖基锚定到癌细胞表面时,它与吞噬细胞上的脂蛋白受体相关蛋白1结合。无论是存在于活细胞还是凋亡细胞的表面,CRT都可以与CD91结合,CD91是吞噬细胞表面的受体。这种相互作用充当CD91的跨激活信号。然而,当存在于吞噬细胞的表面上时,CRT还有助于以CD91以顺式激活方式相互作用的细胞的清除,从而促进增强了受体结合。CRT暴露在巨噬细胞表面上依赖于Toll样受体-布鲁顿酪氨酸激酶(BTK)途径。这个途径触发了CRT的磷酸化和随后的分泌,导致与CD91结合,最终实现了对凋亡细胞的高效摄取。此外,BTK在巨噬细胞中对CRT的磷酸化对于吞噬和清除存活的癌细胞至关重要。实际上,增加巨噬细胞上的CRT表达提高了吞噬的效率。此外,使用抗-CRT抗体的研究表明,吞噬是由位于巨噬细胞细胞表面上的CRT驱动的,而不是位于癌细胞细胞表面上的CRT。这种机制可能在吞噬缺乏CRT的细胞,如红细胞的吞噬中发挥重要作用。 6.SLAMF和巨噬细胞抗原1(Mac-1) 信号淋巴激活分子家族(SLAMF)包括九种单通道跨膜蛋白,包括受体如CD48、Ly9、CD84和信号淋巴激活分子家族成员7(SLAMF7)。这些受体具有2到4个胞外Ig结构域和富含酪氨酸的细胞内尾巴。SLAMF7和Mac-1抗原的相互作用在吞噬过程中至关重要。这种相互作用发生在巨噬细胞表面,并通过Src、Syk和Btk激酶介导的信号级联触发,导致巨噬细胞内吞噬机制的激活。尽管SLAMF7的确切作用机制尚不清楚,但它通过与吞噬细胞中的MAC1相互作用有效促进了吞噬所需的细胞骨架重组。 7.Fc受体 Fc受体属于细胞表面的受体家族,结合免疫球蛋白的Fc区并在免疫细胞中启动下游信号。在这些受体中,IgG受体(FcγR)在肿瘤细胞的抗体依赖性细胞吞噬中发挥关键作用,其中FcγRIIB具有抑制作用,而其他受体(FcγRI、FcγRIIA、FcγRC、FcγRIIIA、FcγRIIIB)作为吞噬激活受体。肿瘤特异性IgG抗体通过与肿瘤抗原的结合使癌细胞具有吞噬性。随后,巨噬细胞通过FcγR表达识别这些抗体的恒定区域,并启动抗体依赖性细胞吞噬。在人类中,FcγRI、FcγRII、FcγRIIIa和FcγRIIIb的细胞内部分具有免疫受体酪氨酸基激活基序,产生促吞噬活性。 【磷脂酰丝氨酸的细胞凋亡和非凋亡作用】 脂质是细胞膜中不可或缺的组成部分,对维持生物体健康至关重要。其中,磷脂、胆固醇和糖脂代表了细胞膜脂质分子的三个基本类别,它们是细胞膜的基本组成部分。不同的脂质组成使得细胞膜的内外两层具有不同的功能。 在哺乳动物细胞的细胞膜中,不同磷脂的不对称分布最初在红细胞中首次观察到,塑造了真核细胞的双层膜。在这些磷脂中,PS以其带有负电的头基团,在真核细胞膜中占据重要位置。PS物种的出现最初是在20世纪40年代,由Folch及其同事在大脑的脂质提取物中检测到的。与其他磷脂一样,PS在甘油部分的sn-1和sn-2位置具有双酰链,与sn-3位置的极性头基团相连。尽管占细胞膜中所有磷脂分子的约4%,但PS在内侧叶片中占20-30%,在外侧叶片中仅占0.2%。对这种不对称性的干扰,导致PS在细胞表面暴露,对细胞凋亡和血凝有关。因此,细胞膜的PS状态成为影响细胞存活、生长、增殖以及与癌症相关表现的重要因素。 PS在1992年被首次记录为出现在细胞膜外表面,并被认为是细胞凋亡的独特特征。这个特征,与其他“吃我”信号一起,有助于识别和吞噬垂死的细胞(胞吞作用),解释了凋亡的免疫静默性质。PS对于激活多种酶和结构组分至关重要,包括清除凋亡细胞和病毒进入宿主细胞等重大事件。两种基本的酶活性调控着PS在叶片之间的分布。第一种是一种依赖ATP的酶,称为翻转酶,它负责协调磷脂和其他分子在外膜和内膜之间的双向运输。第二种酶活性调控着叶片之间的PS分布,催化双层两侧的迅速且非特异性的磷脂交换,称为扰乱酶。翻转酶促使磷脂分子在双层之间进行横向扩散。由P4 ATP酶驱动的ATP水解推动了PS从外质层到细胞质层的转位。翻转酶活性会引发膜中影响细胞生理的生物物理和生化修饰。相反,扰乱酶是独立于ATP且非特异性的,它介导了内外层之间的双向转移。 细胞死亡,被描述为程序性(比如凋亡)或意外的(比如坏死、坏死性凋亡或细胞焦亡),由肿瘤坏死因子(TNF)或细菌感染引发。在凋亡、坏死凋亡或细胞焦亡中,细胞在其表面表达PS,从而导致吞噬细胞吞噬。在凋亡的半胱天冬氨酸酶级联中,下游半胱天冬氨酸酶3/7裂解ATP11A和ATP11C翻转酶并使其失活。与此同时,半胱天冬氨酸酶3/7裂解并激活扰乱酶Xkr8,导致不可逆的裂解和PS暴露。通过恒定活性混乱酶表达PS的细胞保留了功能性翻转酶,导致PS翻转,减少了巨噬细胞上的PS受体亲和力。如果没有翻转酶活性,PS仍然暴露,无法返回到内侧叶片,从而增加了细胞的PS受体亲和力。由于双层的低内在转位,磷脂不对称性的破坏需要时间。因此,扰乱酶会加速细胞凋亡过程中的快速 PS 暴露,并有助于坏死细胞死亡中的PS暴露。TNF诱导的坏死凋亡和细菌诱导的细胞焦亡是由钙流介导的。 由于存在许多PS识别受体,因此许多下游信号传导途径不可避免地涉及其中。值得注意的是,参与PS吞噬作用的整合素可能会独立激活Rho GTP酶,通过与Elmo1-Dock1不同的途径,招募了与整合素信号分子类似的信号传导分子,如聚焦粘附激酶和整合素相关激酶,从而触发了多种下游的RhoGEFs。例如,在类似内皮的小梁网格细胞中,整合素αvβ5的结合通过GEF Tiam1激活,这对吞噬作用至关重要,而Dock1则扮演非重要角色。 同样,GEF Vav3在巨噬细胞中起到下游Rho GTP酶的激活作用,特别是对于整合素αvβ5和直接PS受体TIM4。此外,VAV家族的GEF,特别是Vav1,通过TAM受体(Tyro3,Axl,Mer)对PS的参与作用做出反应。这些受体的胞内催化结构域直接参与受体激酶活性,Mer直接结合并随后释放磷酸化的Vav1。 【结论与未来展望】 开发新的策略来控制癌症的进展并克服治疗失败变得至关重要。抑制性和刺激性信号的复杂相互作用调节着肿瘤细胞的吞噬和随后的免疫识别。为了引发最有效的抗肿瘤反应,必须考虑所有信号。虽然CD47-SIRP轴是最早在癌症中识别的吞噬检查点,但随后的研究揭示了其他吞噬检查点。以前用于在生理和非肿瘤病理情境中识别吞噬的关键调节因子的基因筛选策略可能被扩展到肿瘤学。这一拓展可能会导致发现识别关键吞噬调节因子的新方法,有望揭示新的检查点、刺激性分子以及它们对癌症免疫逃逸的集体影响。显著的好处包括增强疗效、最小化副作用以及精确肿瘤靶向。然而,相关的缺点包括成本高、疗效有限以及可能引发不良的免疫反应。因此,这一策略可能会极大地推动癌症治疗的有效免疫疗法的发展。涉及“吃我”和“别吃我”信号的免疫治疗策略为各种癌症治疗带来了有希望的突破。将以癌症为目标的吞噬信号与其他靶向干预措施,如嵌合抗原受体(CAR)自然杀伤细胞和CAR-T细胞相结合,有望成为未来治疗癌症的一种新而有影响的方法。 * 参考文献见原文 相关论文信息 研究成果发表在Cell Press旗下Heliyon期刊上,点击“阅读全文”或扫描下方二维码查看论文。 ▌论文标题: Don’t eat me/eat me signals as a novel strategy in cancer immunotherapy ▌论文作者: Amirreza Khalaji,Fatereh Baharlouei Yancheshmeh,Fatemeh Farham,Arya Khorram,Shiva Sheshbolouki,Maryam Zokaei,Fatemeh Vatankhah,Mehdi Soleymani-Goloujeh ▌论文网址: https://www.cell.com/heliyon/fulltext/S2405-8440(23)07715-0 ▌DOI: https://doi.org/10.1016/j.heliyon.2023.e20507 1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50多本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。 CellPress细胞出版社 阅读原文 |
【本文地址】