一种新型酶法合成5’ |
您所在的位置:网站首页 › 5胞苷酸二钠功效作用 › 一种新型酶法合成5’ |
一种新型酶法合成5’
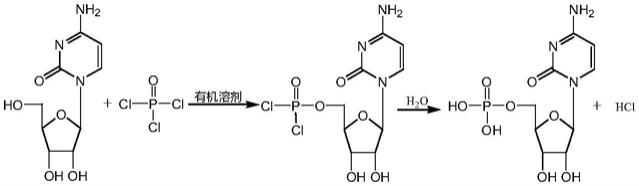 一种新型酶法合成5’‑胞苷酸的方法技术领域1.本发明属于生物制药和生物化工技术领域,具体涉及一种新型酶法合成5’‑胞苷酸的方法。 一种新型酶法合成5’‑胞苷酸的方法技术领域1.本发明属于生物制药和生物化工技术领域,具体涉及一种新型酶法合成5’‑胞苷酸的方法。背景技术: [0002]5’‑胞苷酸是一种重要的核苷酸原料和中间体,可作为食品添加剂、药品以及药物中间体应用于不同领域。5’‑胞苷酸在成年人、婴幼儿及哺乳动物的免疫系统中发挥重要作用,含有5’‑胞苷酸的婴幼儿奶粉能显著提高婴幼儿的免疫力,功效更接近于母乳。5’‑胞苷酸作为制备核苷酸药物及核苷酸衍生物的重要中间体,主要用于制备胞苷三磷酸、胞二磷胆碱钠、阿糖胞苷酸和聚肌胞苷酸等。[0003]目前,生产5’‑胞苷酸的方法主要有两种。一种是利用核酸水解酶水解从酵母中提取的核糖核酸获得5’‑胞苷酸;此方法中酵母中提取的核糖核苷经核酸酶水解后得到的是4种5’‑核苷酸即5’‑腺苷酸、5’‑鸟苷酸、5’‑胞苷酸和5’‑尿苷酸混合物,后经多次离子交换树脂进行分离获得5’‑胞苷酸粗品,再通过精制得到5’‑胞苷酸成品。[0004]此方法存在以下缺点:[0005]1、此工艺生产周期较长、分离纯化工序复杂繁多。[0006]2、收率不高,致使生产成本较高。[0007]3、生产过程中带来大量废水,环保压力较大,同时影响产能。[0008]另一种方法是通过化学法磷酸化胞苷获得5’‑胞苷酸,流程如下所示:[0009][0010]此方法存在以下缺点:[0011]1、此方法中磷酸化试剂通常为三氯氧磷等危险化学品,生产过程中带来的安全隐患较多;[0012]2、此方法生产过程中的三废较多、企业环保压力较大;[0013]3、此方法生产出的5’‑胞苷酸产品还无法应用于食品添加剂领域比如婴幼儿奶粉。[0014]近年来,广大生物化学工作者一直在探索一种温和、高效、经济以及对环境友好5’‑胞苷酸合成方法来替代现有的生产工艺。[0015]生物工作者对此化合物作了一些尝试(chinese journal of biotechnology;issn 1000-3061,cn 11-1998/q),利用尿苷-胞苷激酶和聚磷酸激酶偶联催化胞苷制备5’‑胞苷酸,反应式如下:[0016][0017]目前此方法还存在底物浓度低、转化不完全、辅料atp价格昂贵等缺陷,离产业化还有一定距离。 技术实现要素: [0018]本发明所要解决的第一个技术问题是现有技术中5’‑胞苷酸制备方法反应步骤复杂、收率不理想、成本偏高、环境污染严重且安全隐患较多的问题,进而提供一种反应步骤简单、收率高、成本低、环保且安全的制备5’‑胞苷酸的方法。[0019]本发明所要解决的第二个技术问题是提供一种用于5’‑胞苷酸合成的酶。[0020]本发明所要解决的第三个技术问题是提供一种可产业化制备5’‑胞苷酸的生产工艺。[0021]为此,本发明提供一种用于5’‑胞苷酸合成的酶,此酶来自深圳华酶生物科技有限公司生物实验室,菌株编号hm001,酶代号hme001。[0022]本发明提供一种新型酶法合成5’‑胞苷酸的方法,其中,所述5’‑胞苷酸结构式如下:[0023][0024]酶法合成5’‑胞苷酸的方法包括以下步骤:[0025]a、将胞苷溶于水中,加入聚磷酸盐、hme001酶液后于预定的温度、ph值、常压下进行温和反应;[0026]b、当胞苷转化率达到预定数值时,加热终止反应,过滤去除固体不溶物后,纳滤浓缩;[0027]c、纳滤浓液中加入95%浓度的乙醇使5’‑胞苷酸结晶析出,固液分离后即获得5’‑胞苷酸粗品;[0028]d、5’‑胞苷酸粗品进一步精制,干燥,即获得5’‑胞苷酸精品。[0029]具体的,a步骤中聚磷酸盐包括但不限于焦磷酸钠、三聚磷酸钠、四聚磷酸钠、六偏磷酸钠。[0030]具体的,a步骤中预定的温度为35~40℃,ph值为5.0~6.0。[0031]具体的,b步骤中胞苷转化率》99%时,加热终止反应的温度为70~90℃。[0032]具体的,c步骤中95%浓度的乙醇的加入量为纳滤浓液体积的1~2倍。[0033]具体的,d步骤中精制工序是,将5’‑胞苷酸粗品加入纯水中,溶解后加入活性炭脱色,过滤,用稀酸溶液调节ph值为3.0~4.0,向滤液中加入1~2倍体积的95%浓度的乙醇,在0℃~10℃下结晶,固液分离,固体真空干燥后即得5’‑胞苷酸精品。[0034]本发明所述的新型酶法合成5’‑胞苷酸的反应式如下:[0035][0036]本发明的上述技术方案,相比现有的技术具有以下优点:[0037](1)本发明的新型酶法合成5’‑胞苷酸工艺反应步骤简单、收率高,大幅降低了生产成本,并且制备过程中产生三废的量很少,非常环保绿色。[0038](2)本发明的新型酶法合成5’‑胞苷酸工艺,生物转化的底物浓度可以达到100g/l,反应的转化率高达》99%,有利于实现产业化。[0039](3)本发明的新型酶法合成5’‑胞苷酸工艺,以价格低廉的聚磷酸盐作为磷源供体,极大地降低了成本。[0040](4)本发明的新型酶法合成5’‑胞苷酸工艺,生物转化的用酶量很低,便可使得反应的转化率高达》99%,极大地降低了生产成本。具体实施方式[0041]为了便于理解本发明,下面将对本发明进行更全面的描述。本发明可以以许多不同的形式来实现,并不限于本文所描述的实施方式。相反地,提供这些实施方式的目的是使对本发明的公开内容理解的更加透彻全面。[0042]实施例1[0043]a、5’‑胞苷酸的酶催化反应方法:[0044]取自来水950ml于2000ml的三口瓶中,加入胞苷100g,焦磷酸钠50g,升温至35℃,调ph值至6.0,再加入50ml用于5’‑胞苷酸合成用酶hme001,35℃下搅拌反应16h,反应过程中取样高效液相色谱(hplc)检测,监控反应进程。[0045]b、5’‑胞苷酸酶催化反应终止方法:[0046]反应16h后,当hplc监测到酶催化反应转化率》99%时,将a步骤获得的5’‑胞苷酸酶催化反应液加热至80℃,保温搅拌15min后过滤去除固体不溶物,纳滤浓缩。[0047]c、5’‑胞苷酸反应液后处理粗制方法:[0048]将b步骤中纳滤后的浓液调ph3.0后加入95%浓度的乙醇,乙醇加入量为纳滤后浓液体积的1.5倍,降温至0℃,保温搅拌过夜后进行固液分离,获得的固体即5’‑胞苷酸粗品,5’‑胞苷酸粗品的hplc纯度》99%。[0049]d、5’‑胞苷酸的精制方法:[0050]将5’‑胞苷酸粗品加纯水重新溶解后,加入粗品重量1%的活性炭搅拌脱色后过滤,滤液用稀酸溶液调ph3.0,加入1.5倍体积的95%浓度的乙醇,降温至0℃,保温搅拌过夜后进行固液分离,获得的白色固体真空干燥后即得5’‑胞苷酸成品,共计120g。5’‑胞苷酸精品的hplc纯度》99%,总收率》90%。[0051]实施例2[0052]在实施例1中a步骤中使用的用于5’‑胞苷酸合成用酶hme001的制备方法,如下:[0053]将hm001菌株的单菌落接种到培养基中,在35℃下振荡培养6h,取振荡培养后的培养基以0.5%的接种量转接于新鲜培养基中,在40℃下振荡培养至od600值达到0.5时,加入终浓度为0.5mm的iptg,再置于37℃下,振荡培养8h,振荡培养结束后离心收集细胞,加入适量水重悬细胞,将重悬的细胞置于冰浴中超声破碎细胞,将破碎液离心,收集上清液,即得到用于5’‑胞苷酸合成的酶hme001。[0054]实施例3[0055]基于实施例1,在实施例1中a步骤中使用的用于5’‑胞苷酸合成用酶hme001的制备还可以用以下方法:[0056]将hm001菌株的单菌落接种到5ml液体lb培养基,37℃振荡培养12h,取振荡培养后的培养液以1%的接种量转接于500ml液体lb培养基,37℃振荡培养至od600值达到0.6时,加入终浓度为1mm的iptg,再置于37℃振荡培养16h。培养结束后将培养液于8000rpm下离心10min收集细胞,加50ml水重悬细胞,将重悬的细胞置于冰浴中超声破碎细胞,将破碎液于8000rpm下离心10min,收集上清液即得到用于5’‑胞苷酸合成的酶hme001。[0057]实施例4[0058]基于实施例1,在实施例1中a步骤中的5’‑胞苷酸的酶催化反应还可以采用以下方法:[0059]取自来水950ml于2000ml的三口瓶中,加入胞苷100g,三聚磷酸钠50g,升温至40℃,调ph值至6.0,再加入50ml实施例2或实施例3中制备的胞苷酸合成用酶hme001,40℃下搅拌反应20h,反应过程中取样高效液相色谱(hplc)检测,监控反应进程。[0060]实施例5[0061]基于实施例1,在实施例1中b步骤还可以采用以下方法:[0062]反应16h后,当hplc监测到酶催化反应转化率》99%时,将反应液加热至90℃,保温搅拌30min后过滤去除固体不溶物,纳滤浓缩。[0063]实施例6[0064]基于实施例1,在实施例1中c步骤还可以采用以下方法:[0065]将步骤b中纳滤后的浓液中加入95%浓度的乙醇,乙醇加入量为纳滤后浓液体积的1.5倍,降温至10℃,保温搅拌过夜后进行固液分离,获得的固体即5’‑胞苷酸粗品,5’‑胞苷酸粗品的hplc纯度》99%。[0066]实施例7[0067]基于实施例1,在实施例1中d步骤还可以采用以下方法:[0068]将5’‑胞苷酸粗品加纯水重新溶解后,加入粗品重量1%的活性炭搅拌脱色后过滤,滤液加入95%浓度的乙醇,用稀酸溶液调节ph值为4.0,降温至10℃,保温搅拌过夜后进行固液分离,获得的白色固体真空干燥后即得5’‑胞苷酸成品。[0069]需要说明的是,上述实施例1的a步骤中,5’‑胞苷酸的催化反应方法,按照顺序,升温至35℃还可替换为35~40℃之间的任意值;调ph值至6.0还可替换为ph5.0~6.0之间的任意值,反应16h可以替换为10~20h之间的任意值。[0070]需要说明的是,上述实施例2中,5’‑胞苷酸合成用酶hme001的制备,按照顺序,35℃还可替换为35~40℃之间的任意值;振荡6h还可以替换为5~16h之间的任意值;0.5%的接种量还可以替换为0.5~2%之间的任意值;40℃还可以替换为35~40℃之间的任意值;od600值0.5还可以替换为0.3~0.8之间的任意值;iptg终浓度0.5mm还可以替换为0.4~1mm;振荡培养8h还可以替换为6~20h之间的任意值。[0071]需要说明的是,上述实施例1的b步骤,按照顺序,加热至80℃还可以替换为70~90℃之间的任意值,搅拌15min可以替换为15~30min之间的任意值。[0072]需要说明的是,上述实施例1的c步骤,按照顺序,降温至0℃可以替换为0℃~10℃之间的任意值。[0073]需要说明的是,上述步骤实施例1的d步骤,按照顺序,调节ph值为3.0还可替换为3.0~4.0,降温至0℃还可以替换为0~10℃之间的任意值。[0074]综上所述,本发明的新型酶法合成5’‑胞苷酸工艺反应步骤简单、收率高,大幅降低了生产成本,并且制备过程中产生三废的量很少,非常环保绿色;生物转化的底物浓度可以达到100g/l,反应的转化率高达》99%,有利于实现产业化;生物转化的用酶量很低,便可使得反应的转化率高达》99%,极大地降低了生产成本。[0075]显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来讲,在上述说明的基础上还可以做出其它不同形式的变动或变化。这里无需也无法对所有的实施方式予以穷举。而由此所引申的显而易见的变动或变化仍处于本发明创造的保护范围之中。 |
【本文地址】