从3d和4s能级比较谈谈“能量最低原理” |
您所在的位置:网站首页 › 3d轨道包含几个原子轨道 › 从3d和4s能级比较谈谈“能量最低原理” |
从3d和4s能级比较谈谈“能量最低原理”
|
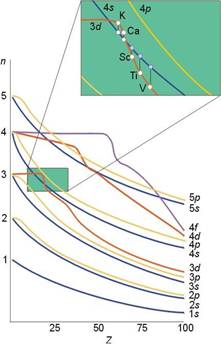
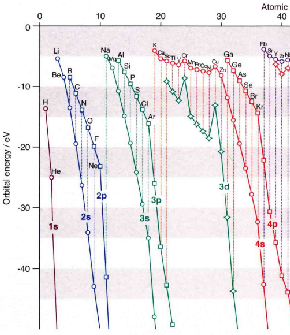
【声明】本文适合化学竞赛学生及教师阅读,并非专为选修3模块所写 在一般情况下,电子按原子轨道能由低到高填充排布,可使体系能量最低。但是,原子轨道的能量(轨道能)随其本身及其它原子轨道的电子占据情况(库仑作用、电子自旋、轨道磁矩间作用)而动态变化,故不同元素的原子轨道能的能序不同,不能一成不变地看待。例如3d和4s轨道,作为外层轨道时的能量差得不多,但随着电子填充(当然质子数也在增大),3d与4s轨道能的变化很灵敏,于是出现了能级交错现象(见下,左图为Cotton能级图,或右图参阅某些中性原子的轨道能量的负值表):
当原子序数Z =1-14,E4s>E3d,正常;Z =15-20,E4sE3d,正常。 于此可见,有时E3d>E4s,有时E3dE4s。又如21Sc电子排布为[Ar]3d14s2,由于内层3d轨道上有电子,对外层4s轨道上的电子有屏蔽作用,故E3d |
【本文地址】
今日新闻 |
推荐新闻 |