100dB SPL白噪声暴露对小鼠耳蜗听神经髓鞘的影响 |
您所在的位置:网站首页 › 150db的噪声 › 100dB SPL白噪声暴露对小鼠耳蜗听神经髓鞘的影响 |
100dB SPL白噪声暴露对小鼠耳蜗听神经髓鞘的影响
|
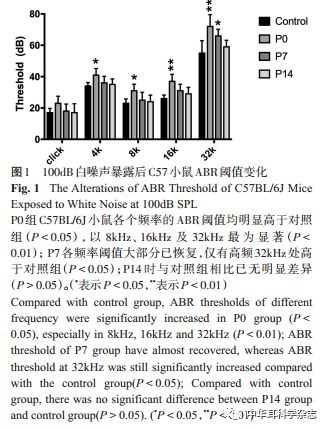
噪声暴露前为确保扬声器工作期间的声强变化 1dB,先使用标准声级计(AWA5636 型,测量指标 LFp dBA,北京宏昌信科技有限公司)对声音进行校准,使鼠笼中的声音强度符合标准。随后将小鼠置于鼠笼(尺寸约为4cm×4cm×16cm大小)中,放置于扬声器的正下方。采用100dB声压级(SPL)的宽频带白噪声进行暴露,持续2小时。 1.3 ABR检测 本实验应用美国 TDT测听模块设备,biosig测听软件系统对小鼠进行 ABR检测。测听过程在隔声 屏 蔽 室 内 进 行 ,检 测 前 使 用 10% 水 合 氯 醛(0.0045ml~0.005ml/g,腹腔注射)对小鼠进行麻醉。麻醉满意后,将记录电极置于小鼠双侧耳廓前缘连线中点皮下,参考电极置于测试耳耳后皮下,接地电极置于对侧耳耳后皮下,测试耳机距外耳道口约 0.5cm,检测小鼠双耳的 ABR阈值。实验采用短声(Click)和短纯音(Toneburst,Rise/Fall time: 1msec;Duration: 4 msec)作为刺激声,带通滤波为300~3000Hz,叠 加 次 数 为 1024 次 ,扫 描 时 间10ms。刺激强度自 90dB SPL 开始,以 10dB逐渐递减,直至检测不出重复的 ABR 波形,再向上增强5dB,直至能检测出重复的 ABR 波形,此刺激声强度即为小鼠的听阈。 1.4 耳蜗基底膜取材及免疫组化标记 测听结束后以颈椎脱臼法处死小鼠,眼科剪迅速断头,去除脑组织,快速分离颞骨与耳蜗,去除蜗壳,将耳蜗放入装有 4%多聚甲醛溶液的培养皿中。在解剖显微镜下,用细镊在蜗顶钻孔,并开放圆窗和卵圆窗。将4%多聚甲醛溶液自蜗顶进行灌流,冲出淋巴液,灌流完成后继续置于4%多聚甲醛溶液中固定,4℃冰箱过夜。次日取出标本置于10%EDTA 溶液中脱钙 3 小时,将已脱钙的耳蜗标本放入 PBS溶液培养皿中,缓慢剥去软化的蜗壳,切除螺旋韧带,并去除前庭膜及盖膜,分离蜗轴和基底膜。 将分离好的基底膜置于配制好的 Triton100-X打孔 30 分钟,含 PBS 缓冲液的 5%山羊血清封闭 1小时。漂洗充分后加入一抗(大鼠来源 MBP,1:200,Millipore;鸡来源 NF200,1:600,Chemicon)后4℃孵育过夜,次日用 PBS 清洗 3 次,每次 5-10 分钟,再加入二抗(羊抗大鼠 488抗体,1:300,Invitrogen,用以标记一抗 MBP;羊抗鸡 594 抗体,1:300,Invitrogen,用以标记一抗 NF200) 室温避光孵育 2小时,随后清洗 3次,每次 5-10分钟。最后在载玻片上滴加一滴(约 40ul)免洗 DAPI液,解剖显微镜下铺片后,将盖玻片倒扣于载玻片上避光保存。 1.5 耳蜗冰冻切片标本制备及免疫组化标记 ABR检测后处死动物,快速分离出耳蜗,去除蜗壳,将耳蜗放入有4%多聚甲醛溶液的培养皿中,于蜗顶钻孔、开放圆窗和卵圆窗进行灌流,完成后放入4%多聚甲醛溶液中固定,4℃冰箱过夜。次日将耳蜗用置入10% EDTA脱钙液中脱钙,室温条件下12小时。其后用PBS溶液洗脱3次,在解剖显微镜下修剪标本,置于 20%蔗糖溶液中脱水,室温放置 2小时。取出耳蜗,再置入 OCT包埋剂中浸泡,室温下浸胶 2小时。浸胶完成后放于冰冻切片机(LEIv CA CM1950)中切片,操作温度需于-20℃以下,设置片厚为 10um。切片完成后,在烤箱(60℃)中烤片20分钟。 PBS 溶液将烤制好的切片清洗 5 分钟,用含0.3%TritonX-100 的 PBS 浸泡 30 分钟,随后用含10%羊血清+1%BSA的PBS封闭1小时。置于一抗(大鼠来源 MBP,1:200,Millipore;鸡来源 NF200,1:600,Chemicon)中 4℃孵育过夜。次日经 PBS 清洗后,加入二抗(羊抗大鼠488抗体,1:300,Invitrogen;羊抗鸡 594抗体,1:300,Invitrogen)溶液,室温避光孵育2小时。PBS清洗后滴加免洗DAPI液后,封片避光保存。 1.6 激光共聚焦显微镜成像 将耳蜗基底膜铺片置于Leica正置共聚焦显微镜(TCS SP5 II;Leica Microsystems, Wetzlar, Germany)63×油镜下观察,选择激发光波长为 405nm、488nm以及594nm对标本进行层扫,荧光激发下分别显示蓝色、绿色和红色,设置扫描层距为0.35um/层。以荧光信号出现时开始层扫,以信号消失时结束,将所有层扫图片叠加后形成最终的结果图片。 1.7 透射电子显微镜标本制备及成像 处死小鼠后快速将耳蜗剥出并放入 2.5%戊二醛溶液中进行灌流,冲出淋巴液后置于 2.5%戊二醛溶液中固定,4℃冰箱过夜。次日 10%EDTA溶液脱钙后剥去软化的蜗壳,分离出基底膜,并去除前庭膜及盖膜。将标本经梯度酒精脱水,再置于100%丙酮与 EPON 812 1:1 混合液中浸透 40 分钟。包埋剂加 DMP-30浸透 12小时。将包埋剂注入平板包埋模内,再把基底膜组织按切片要求放进包埋板内。将包埋好的组织块放入干燥器中,烤箱35℃聚合 12小时,45℃聚合 12小时,60℃聚合 24小时。之后将组织暴露,修成梯形,切半薄切片,染色定位。醋酸双氧铀饱和液染色 30分钟,柠檬酸铅染 色 10~15 分 钟 。最 后 在 透 射 电 子 显 微 镜(JEM-1400plus, Japan)下观察髓鞘形态变化情况。 1.8 透射电镜听神经髓鞘直径计数 本研究采用 Image J software ( SummaSketch III Summagraphics,Seattle,WA) 测量神经纤维轴突和总神经纤维(轴突+髓鞘)直径。本研究按照先前研究方法[7]测量有髓神经纤维直径包括确定神经纤维断面最长轴,其直径为与最长轴相垂直的神经纤维横径中最长横径,并计算出 g-ratio 值(=神经纤维轴突直径/总神经纤维的直径);g-ratio 值越大,表明髓鞘越薄,反之表明髓鞘变厚。计数时分别以 3个神经纤维为 1个计数矩形视野,分别计算出视野中 3个 g-ratio值,除以 3得到每个听神经纤维的平均 g-ratio值,每个耳蜗标本随机选取 5个视野,共计 4个标本(20个视野),最后统计出每组小鼠g-ratio值(均数±标准差)。 1.9 统计学方法 资料分析采用 SPSS 18.0 统计软件,对照组与噪声暴露后各组 ABR阈值总体比较采用单因素方差分析,各组组间比较应用 Dunnet 或 LSD 法检验。听神经髓鞘 g-ratio值计数结果也采用单因素方差分析,比较各时间点与未暴露组的差别,P<0.05差异具有统计学意义。 2 实验结果 2.1 100dB SPL白噪声暴露 2小时对小鼠 ABR听阈的影响 C57BL/6J 小鼠在噪声暴露前,其各个频率的听力阈值分别为:Click(16.7±2.6dB)、4kHz(34.2±3.8dB)、8kHz(23.3±2.6dB)、16kHz(25.8±3.8dB)和32kHz(55.0±7.1dB)。100dB 白噪声条件下暴露 2小时后即刻(P0),测得 Click(23.3±4.1dB)(F=3.58,P=0.01)和 4kHz(39.2±3.8dB)(F=2.71,P=0.02)频率的听力阈值较暴露前明显差异(P<0.05),而在8kHz(30.8±3.8dB)(F=5.05,P=0.002)、16kHz(38.3±5.2dB)(F=10.43,P=0.000)、32kHz(72.5 ± 6.9dB)(F=10.48,P=0.000)处 阈 值 升 高 更 为 显 著(P<0.01)。暴露后 7 天(P7),Click(18.3±4.1dB)(F=3.58,P=0.49)、4kHz(35.8 ± 3.8dB)(F=2.71,P=0.39)、8kHz(25.0±4.5dB)(F=5.05,P=0.45)、16kHz(30.0±4.5dB)(F=10.43,P=0.89)处阈值已逐渐恢复到 暴 露 前 水 平(P>0.05),仅 高 频 32kHz(63.3 ±4.1dB)(F=10.48,P=0.02)处 阈 移 有 统 计 学 意 义(P<0.05)。暴露后 14 天(P14),观察到各频率听阈水平均已恢复至暴露前水平(P>0.05),表明100dB SPL白噪声暴露 2小时导致 C57小鼠出现暂时性阈移(图1)。
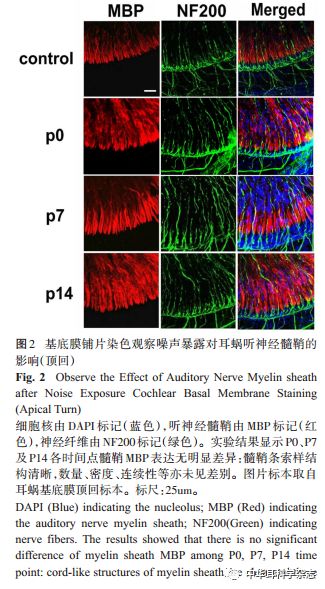
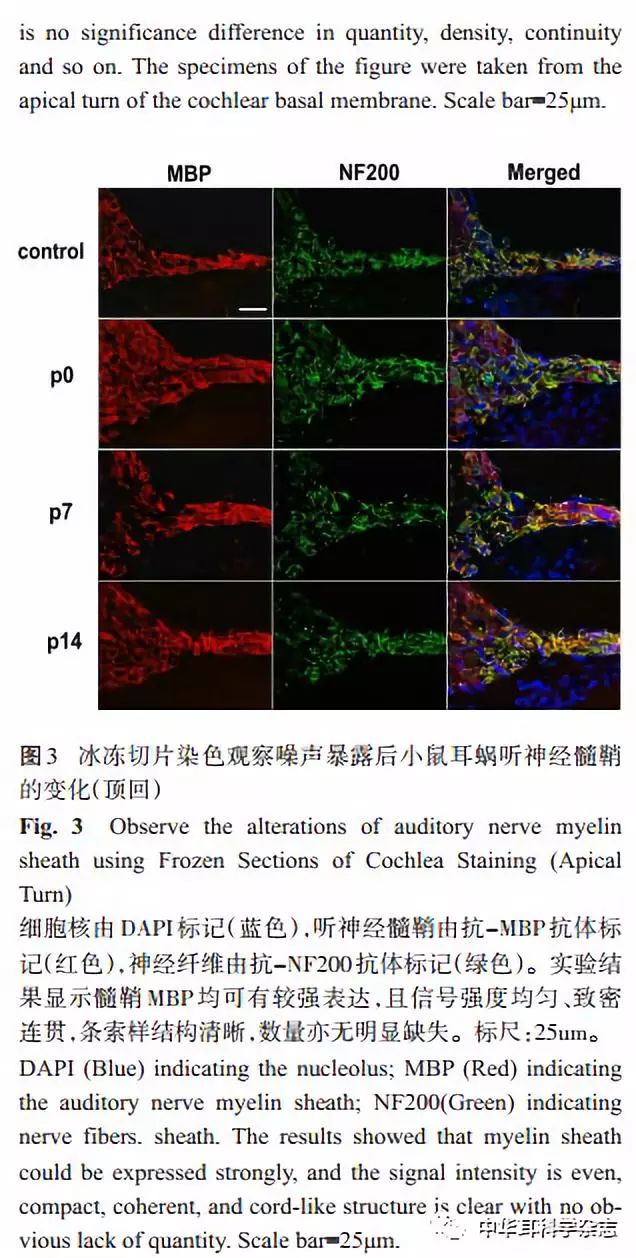
2.2 100dB SPL 白噪声暴露对小鼠听神经髓鞘影响的免疫荧光观察 应用髓鞘碱性蛋白(myelin basic protein,MBP)对听神经髓鞘进行标记,我们观察耳蜗基底膜共聚焦显微镜发现,与对照组小鼠相比,C57BL/6J小鼠在100dB宽频带白噪声暴露后,听神经髓鞘各时间均无明显缺失及断裂、排列均匀一致,整体上形态未受明显影响(图 2)。而观察冰冻切片染色可见,相比于对照组,听神经髓鞘各时间点均排列整齐、结构典型,纤维数量及信号强度亦无明显差异(图3)。本实验结果表明 100dB 宽频带白噪声暴露 2小时可能并未明显损害 C57小鼠听神经髓鞘的形态结构,为了进一步验证此结论,我们下一步将对小鼠听神经髓鞘的超微结构进行观察。
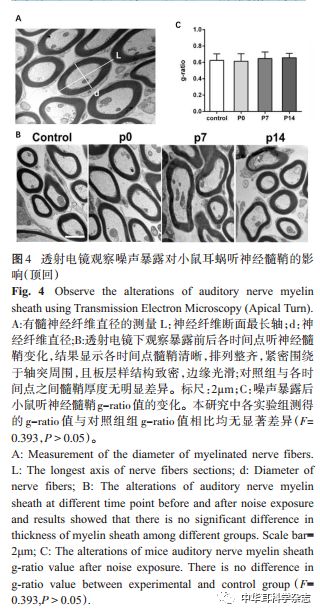
2.3 100dB SPL 白噪声暴露对小鼠听神经髓鞘影超微结构影响 本研究采用透射电镜对实验组及对照组小鼠的听神经髓鞘进行观察。结果发现对照组小鼠听神经髓鞘在透射电镜下大部分都呈同心圆状、板层样结构,且板层均匀致密,边缘光滑完整(图4A-B)。接下来,我们经过计算得到其髓鞘 g-ratio值分别为0.62±0.08(Control)、0.61±0.09(P0)、0.65±0.08(P7)及 0.66±0.05(P14),各组间 g-ratio值无统计学差异,验证了噪声暴露前后神经髓鞘厚度无明显变化(F=0.393,P>0.05)(图 4C),本结果表明髓鞘在中等强度白噪声暴露2小时后形态上并无显著改变,不足以表明听神经出现明显的脱髓鞘现象。
3 讨 论 噪声性聋是一种由于长期暴露于损害性噪声环境下出现的感音性聋,早期多表现为一过性听阈升高,而往往在脱离噪声环境后可逐渐恢复,称暂时性阈移。本实验通过对 6周龄雄性 C57BL/6J小鼠进行 100dB宽频带白噪声暴露 2小时,观察发现噪声暴露后即刻,小鼠各频率的阈移即为最大值,且以高频处的听力损失最为严重(10~20dB左右),而在噪声暴露后第 14天小鼠各频率 ABR阈值则完全恢复,再次验证了本实验室之前的研究结果[7-9]。在此条件下,我们依据先前实验方法对本研究中小鼠听神经髓鞘的变化情况进行观察分析 [10]。通过对约占髓鞘蛋白 1/3且具有神经特异性的髓鞘碱性蛋白(MBP)进行免疫组化染色,发现小鼠听神经髓鞘在暴露即刻以及其后的两周之内均未发生明显的损伤,形态结构无显著变化。再经透射电镜统计各时间点的髓鞘 g-ratio 值(神经轴突直径/总神经纤维直径),也再次证明在中等强度宽频带白噪声暴露 2小时后,小鼠的听神经髓鞘并不能影响髓鞘的厚度以及造成明显的脱髓鞘改变。 听神经髓鞘是由施旺细胞缠绕形成的节段性结构,能起到绝缘和保护轴突的作用,并且由两端的髓鞘节段末端和之间裸露的轴突构成郎氏节,是轴突信号实现跳跃式传递的基础[11-12]。而神经纤维的直径、髓鞘的厚度均可影响神经信息的传导速度,因此脱髓鞘改变可能会导致信息传导速度下降,进而引起神经元协调刺激的能力受损[13]。而本研究结果并不能表明隐性听力损伤与听神经髓鞘间的关系,有很多研究证实,中等强度噪声暴露后小鼠耳蜗带状突触会有明显减少[14,15],带状突触结构的存在能使听觉信息由内毛细胞瞬时、持续且高保真地传入相连的听觉纤维[16],因此推测其功能障碍或数量减少是听力损伤的主要原因。 本实验通过采用 100dB SPL 的宽频带白噪声对小鼠进行暴露,并研究了此条件下小鼠听力损伤及髓鞘形态学特点。为今后进一步探讨相关形态学变化及病理机制奠定了基础。本研究也同样存在许多不足之处,如我们没有进行隐匿性听力损失方面的有效检测,也尚未对血清髓鞘蛋白含量进行评价,因此本文的结论存在不确定性,也是我们今后研究的重要课题。返回搜狐,查看更多 |
【本文地址】